4月19日,International Journal of Biological Macromolecules(影响因子6.953)以长文(Research Article)形式在线发表梁毅教授的最新研究成果,论文题为“Zinc enhances liquid-liquid phase separation of Tau protein and aggravates mitochondrial damages in cells”(锌离子促进Tau蛋白液-液相分离,加剧Tau聚集引发的线粒体损伤),该工作发现锌离子可以促进细胞中Tau蛋白与G3BP1共定位和相互作用,进而促进Tau蛋白的液-液相分离,加剧Tau聚集引发的线粒体损伤从而促进Tau蛋白毒性,揭示了锌离子调控Tau蛋白相分离与细胞毒性的分子机制。
阿尔茨海默病(AD)是当今社会发病率最高的神经退行性疾病,患病人数日益增多,Tau蛋白在神经元内发生病理磷酸化修饰和错误折叠形成有规则的纤维化聚集体(神经纤维缠结)是AD的重要病理特征。人体内的Tau蛋白和锌离子都主要富集在人中枢神经系统神经细胞的轴突中。锌离子是人体内重要的微量元素和无机离子,其稳态调控在生命活动正常运转的过程中起到重要作用;锌离子稳态失衡在多种疾病包括神经退行性疾病发生发展中发挥关键作用,在AD患者的脑中,锌离子含量显著升高。Tau 的液-液相分离可以导致其在神经细胞中的错误折叠与聚集。然而,尚不清楚锌离子是否可以调节细胞中Tau液滴的形成,以及是否可以加剧Tau聚集引发的线粒体损伤。
在蛋白质二硫键异构酶(PDI)和杨梅素调控Tau蛋白相分离、细胞自噬和毒性前期工作(2020年3月27日和2021年9月22日分别发表于Journal of Molecular Biology和Journal of Biological Chemistry)中,梁毅教授研究团队揭示了PDI对Tau蛋白液滴形成、聚集和毒性的调控机制及其在AD中的作用,阐释了PDI及其巯基亚硝基化修饰调节Tau相分离并引发疾病的分子机制,发现天然黄酮类化合物杨梅素可以减缓Tau蛋白液-液相分离,激活细胞自噬从而抑制Tau蛋白毒性,揭示了Tau蛋白相分离与细胞自噬调控的分子机制。
在该项研究中,梁毅教授研究团队运用激光共聚焦显微镜、浊度测定和荧光漂白恢复方法,报告了病理浓度锌离子不仅显著促进了全长Tau蛋白的液-液相分离,将平衡相边界迁移到更低的蛋白质浓度,而且还显著促进了神经细胞中 Tau蛋白的病理磷酸化修饰和错误折叠。同时,该研究团队运用激光共聚焦显微镜、免疫共沉淀和免疫印迹等方法,发现锌离子通过结合全长Tau蛋白的Cys291和Cys322来促进细胞中Tau蛋白与G3BP1共定位和相互作用,进而促进Tau蛋白的液-液相分离和应激颗粒的形成,与此同时,锌离子加剧了Tau聚集引发的线粒体损伤和活性氧(ROS)上调,并引发细胞毒性。这项工作的实验结果表明,锌离子是阿尔茨海默病(AD)的负调控因子。
这项工作的研究结果首次揭示了锌离子对细胞中Tau液滴形成、线粒体损伤和Tau蛋白毒性的调控机制,阐释了锌稳态失衡以及Tau蛋白相分离在AD发病机制中的作用,因此锌离子作为AD等神经退行性疾病的负调控因子,在促进Tau液-液相分离和加剧Tau聚集引发的线粒体损伤中发挥着重要作用,为无机离子靶向治疗AD提供了新的视角,也为AD的起因和发生以及早期诊断提供了有用的线索,具有重要的科学意义。
武汉大学为第一署名单位,生命科学学院2018级博士研究生高莹莹为第一作者,2021级博士研究生钟涛为并列第一作者,梁毅教授为通讯作者。这项研究工作得到了国家自然科学基金委和国家科技部的资助。
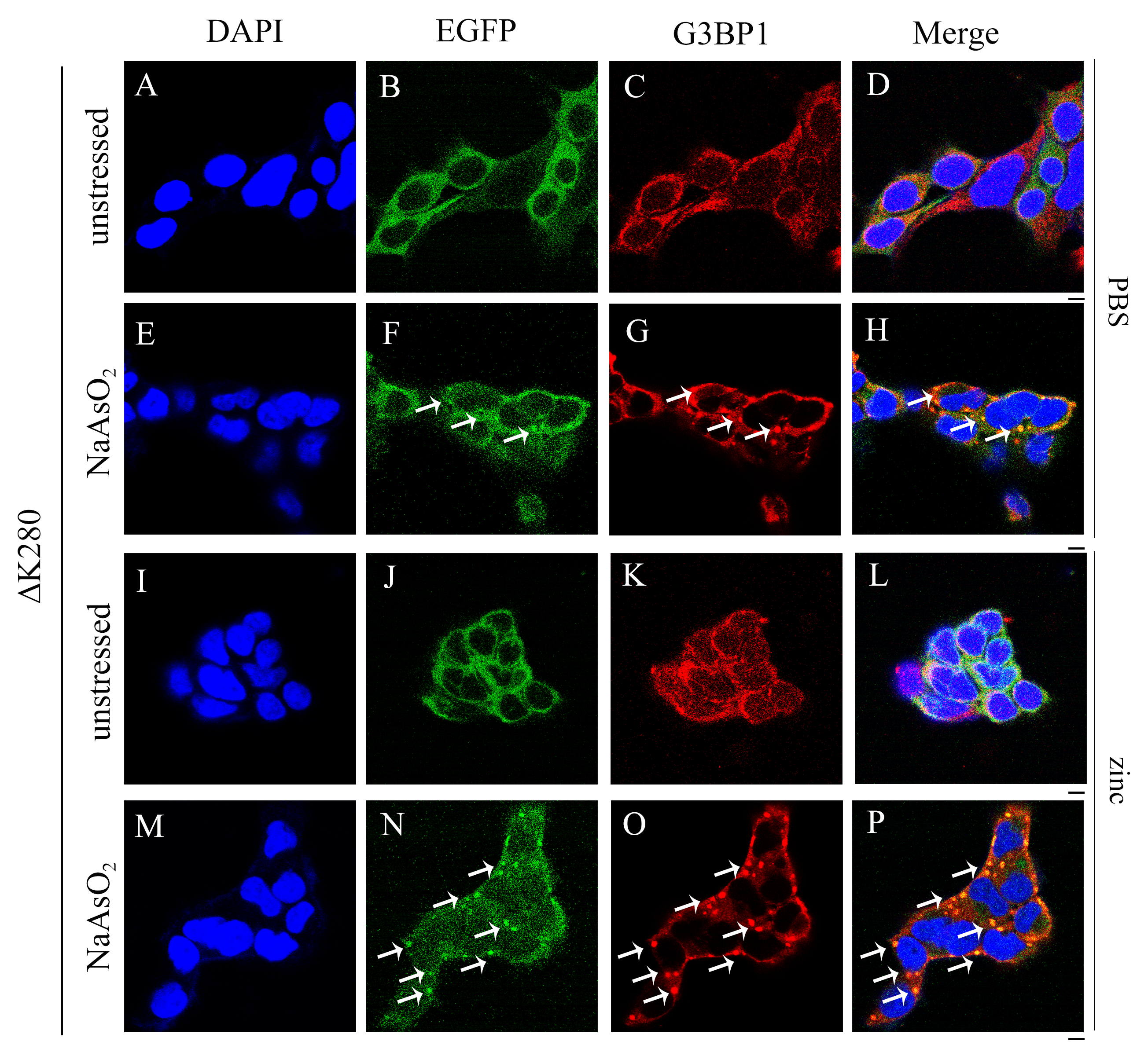
▲ 锌离子促进细胞中Tau蛋白与G3BP1共定位。证实锌离子在细胞中通过促进全长Tau蛋白与G3BP1的共定位,从而促进Tau蛋白在细胞中相分离的发生
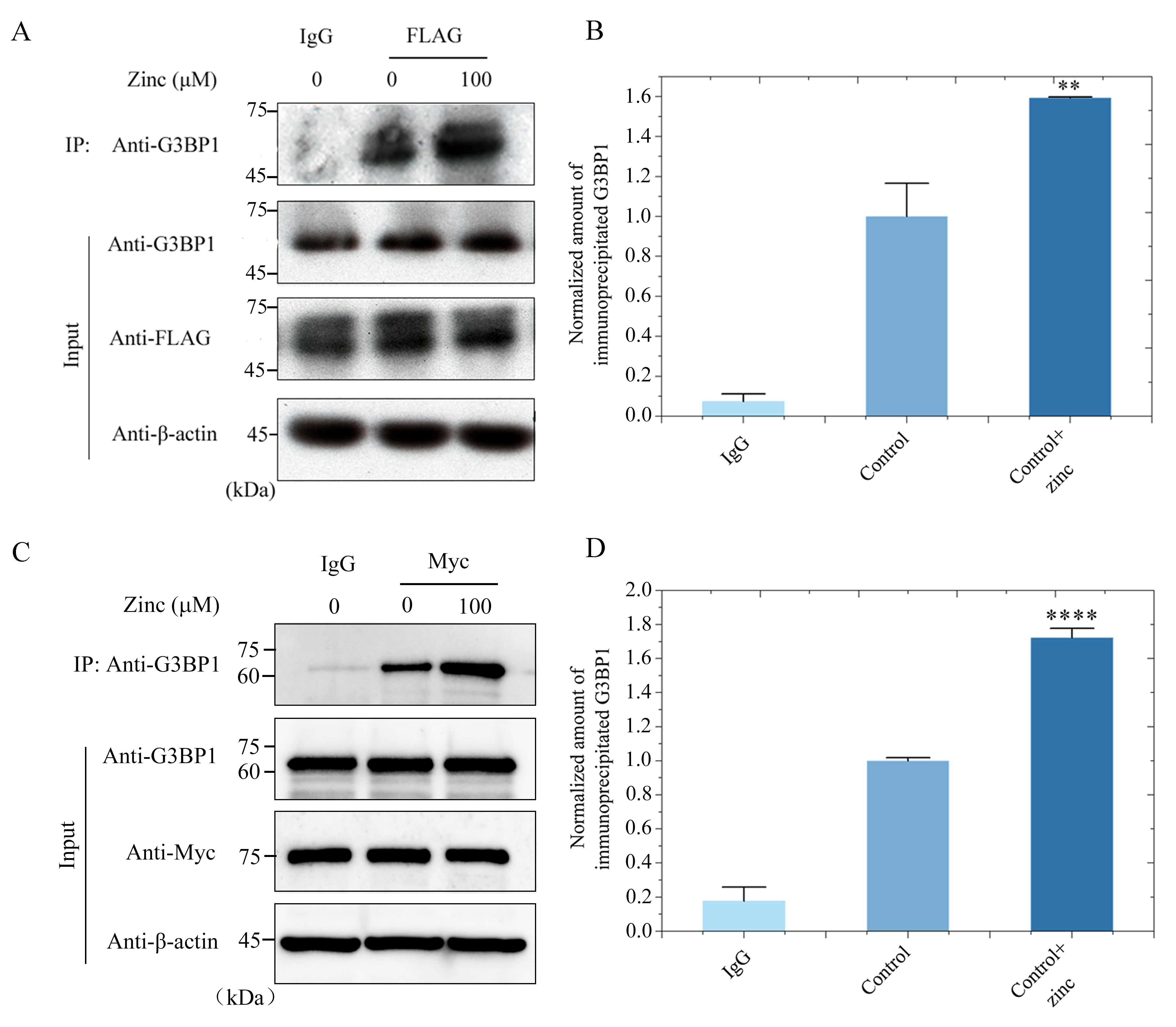
▲ 锌离子促进Tau蛋白与G3BP1的相互作用
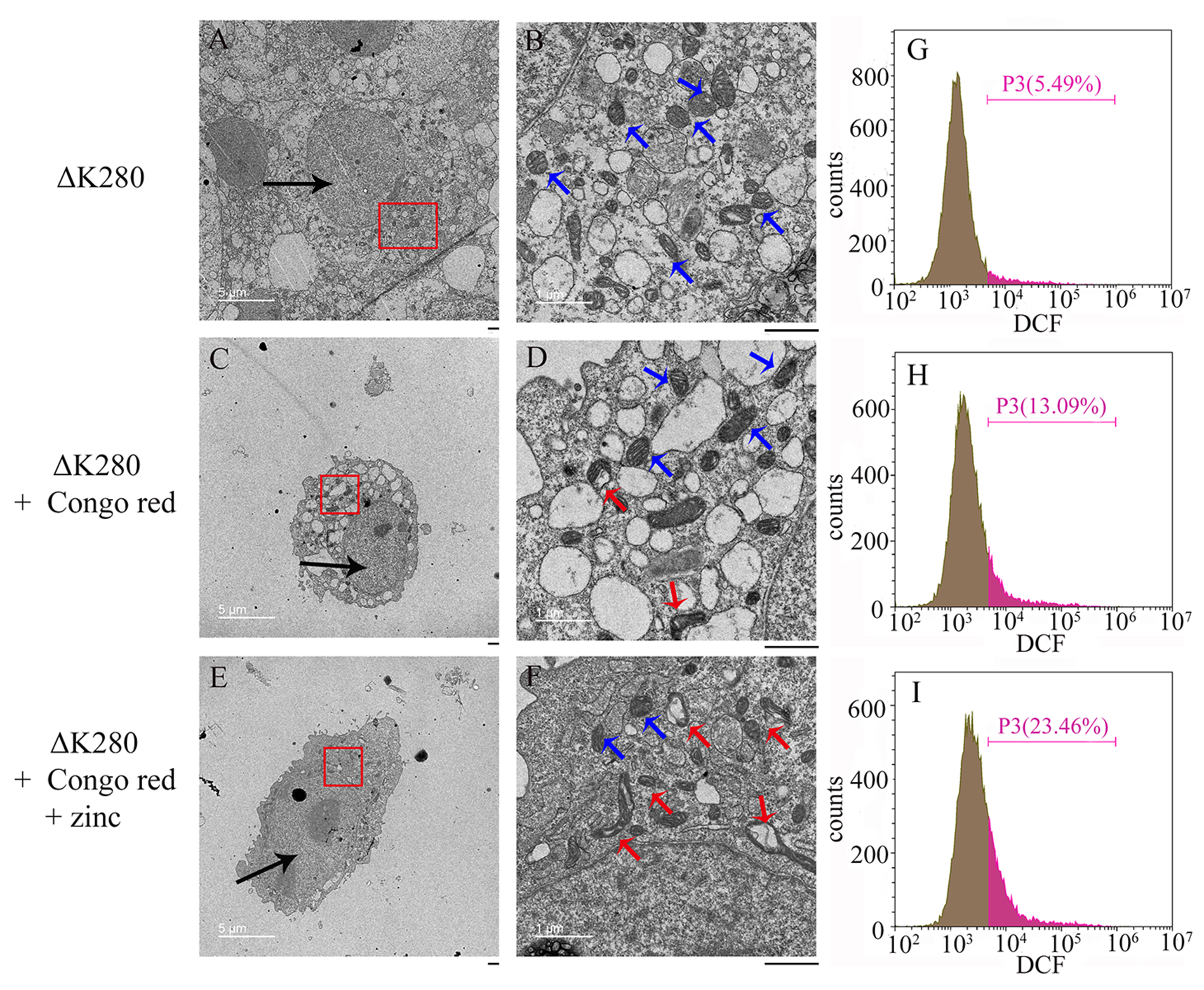
▲ 锌离子加剧Tau聚集引发的线粒体损伤和活性氧(ROS)上调
论文链接:https://doi.org/10.1016/j.ijbiomac.2022.04.034