2024年9月18日,武汉大学生命科学学院杜世燊研究团队与中国科学技术大学杨新星研究团队在Nature Communications发表了题为“The divisome is a self-enhancing machine in Escherichia coli and Caulobacter crescentus”的研究论文。该论文发现FtsZ交联蛋白在Z环(细菌分裂机器的支架)的凝聚及稳定方面发挥关键作用;同时,该研究发现分裂隔板肽聚糖(septal peptidoglycan, sPG)的合成可以促进Z环的凝聚和稳定,并揭示了其分子机制。基于上述发现,该论文提出了细菌的分裂体是一个自我增强的生物大分子机器的新概念,为进一步深入研究细菌的分裂过程提供了重要的思路。

细胞分裂是生命体增殖和发育的基本过程。大多数细菌依赖骨架蛋白FtsZ进行二分裂(Binary fission)。FtsZ是真核生物微管蛋白(tubulin)的同源物,其在细胞中部聚合形成一个不连续且高度动态的环状结构(Z ring)而开启细菌的分裂过程(图1a)。Z环不仅确定了细胞分裂的位置,还是细菌分裂机器(也被称为分裂体,Divisome)的支架。此外,Z环还通过其动态行为指引分裂隔板细胞壁的合成。可以说,Z环是驱动细菌分裂的引擎,研究其形成、动态、定位和稳定性维持的分子机制是细菌分裂研究的核心科学问题。
早期的研究发现,FtsZ纤维首先通过其膜锚定蛋白被连接到细胞内膜上,并在多种空间调控系统的作用下在细胞中部聚集形成一个松散的环状结构。随后,这个弥散的环状结构快速凝聚为一个宽度约为100 nm,厚度约为50 nm的成熟Z环。近年来的研究表明,Z环的凝聚和稳定是细菌正常分裂的关键。但是,FtsZ纤维如何凝聚为成熟的Z环及在分裂位点保持稳定仍然是个未解之谜。该研究以大肠杆菌为模型,深入研究了FtsZ交联蛋白(FtsZ-associated proteins, Zap),一类可以交联FtsZ纤维的非必需分裂蛋白,在Z环凝聚和维持稳定性过程中的作用。结果显示,虽然单个Zap蛋白的缺失仅对Z环的凝聚和稳定产生轻微的影响,但是多个Zap蛋白缺失后,FtsZ纤维无法凝聚为Z环或形成极不稳定的松散环状结构,导致分裂体的组装和分裂隔板的合成出现显著的缺陷,进而导致严重的细胞分裂缺陷(图1b-c)。这些发现表明Zap蛋白协同发挥作用,促进Z环凝聚和维持Z环的稳定,并对后续分裂过程具有重要的影响。有意思的是,此前研究人员在模式革兰氏阳性菌枯草芽孢杆菌中也观察到了相似的现象,表明采用FtsZ交联蛋白辅助Z环的凝聚和稳定是保守的机制。
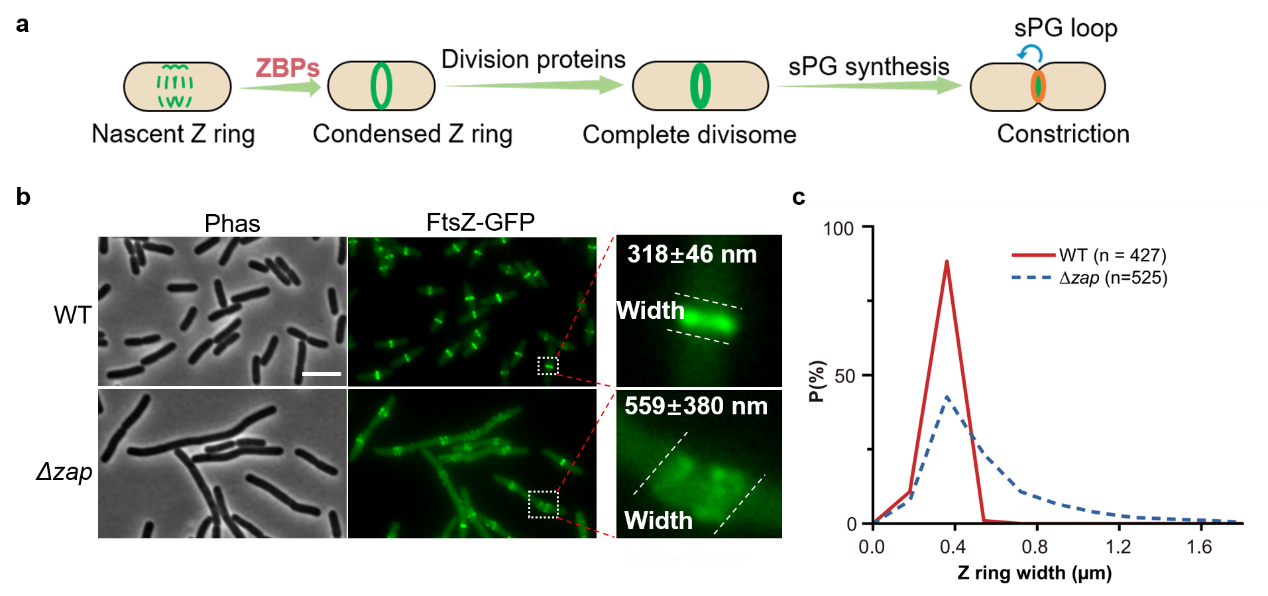
图1. Zaps蛋白的缺失影响细胞的形态和Z环凝聚。
在研究Zap蛋白对Z环的影响的过程中,该研究意外发现在缺失多个Zap蛋白的细胞(Δzap细胞)中过量表达分裂蛋白FtsN可以恢复Z环的凝聚和细胞分裂。FtsN是分裂隔板肽聚糖sPG合成的开关蛋白,它通过多个结构域与sPG合成复合物FtsQLBWI相互作用引起分裂体的构象变化,从而激发sPG合成酶FtsWI的活性。同时,FtsN的SPOR结构域可以与分裂过程中产生的裸露聚糖链结合,促进其自身的招募从而形成sPG合成的正反馈(sPG loop)。基于上述表型和FtsN在sPG合成中的作用,论文作者猜测增强sPG的合成可能可以反向促进Z环的凝聚及稳定。与该推测相符,论文作者发现在sPG合成复合物中引入增强sPG合成活性的激活突变(包括ftsA*, ftsI*, ftsL*和ftsW*)也可以显著抑制Zap蛋白缺失后造成的细胞形态缺陷和Z环凝聚缺陷(图2)。进一步研究发现,sPG合成对Z环凝聚的促进作用依赖于FtsZ膜锚定蛋白FtsA与FtsQLBWI复合物中FtsN及FtsW之间的相互作用。同时,FtsN的SPOR结构域介导的sPG合成正反馈环路在该过程中也发挥重要作用。
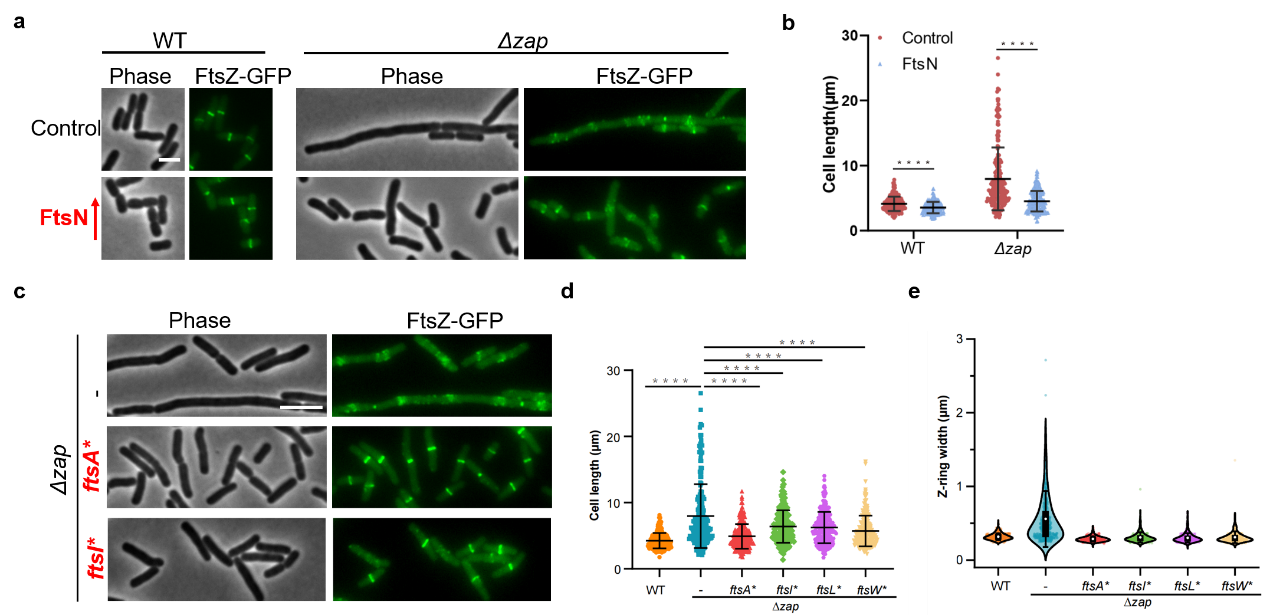
图2. 提高sPG合成促进大肠杆菌Δzap细胞中Z环的凝聚和细胞分裂。
此外,论文作者发现分裂隔板sPG合成对Z环凝聚和稳定的促进作用在另一个模式细菌新月柄杆菌中同样存在,表明这是细菌中的一个保守机制(图3)。基于上述发现,论文作者认为Z环与分裂隔板sPG的合成间具有一个双向的正反馈通路,即Z环的凝聚和稳定驱动分裂隔板sPG的合成,而后者又可以反过来通过sPG合成复合物FtsQLBWIN与Z环膜锚定蛋白FtsA的互作增进Z环的凝聚和稳定(图4)。
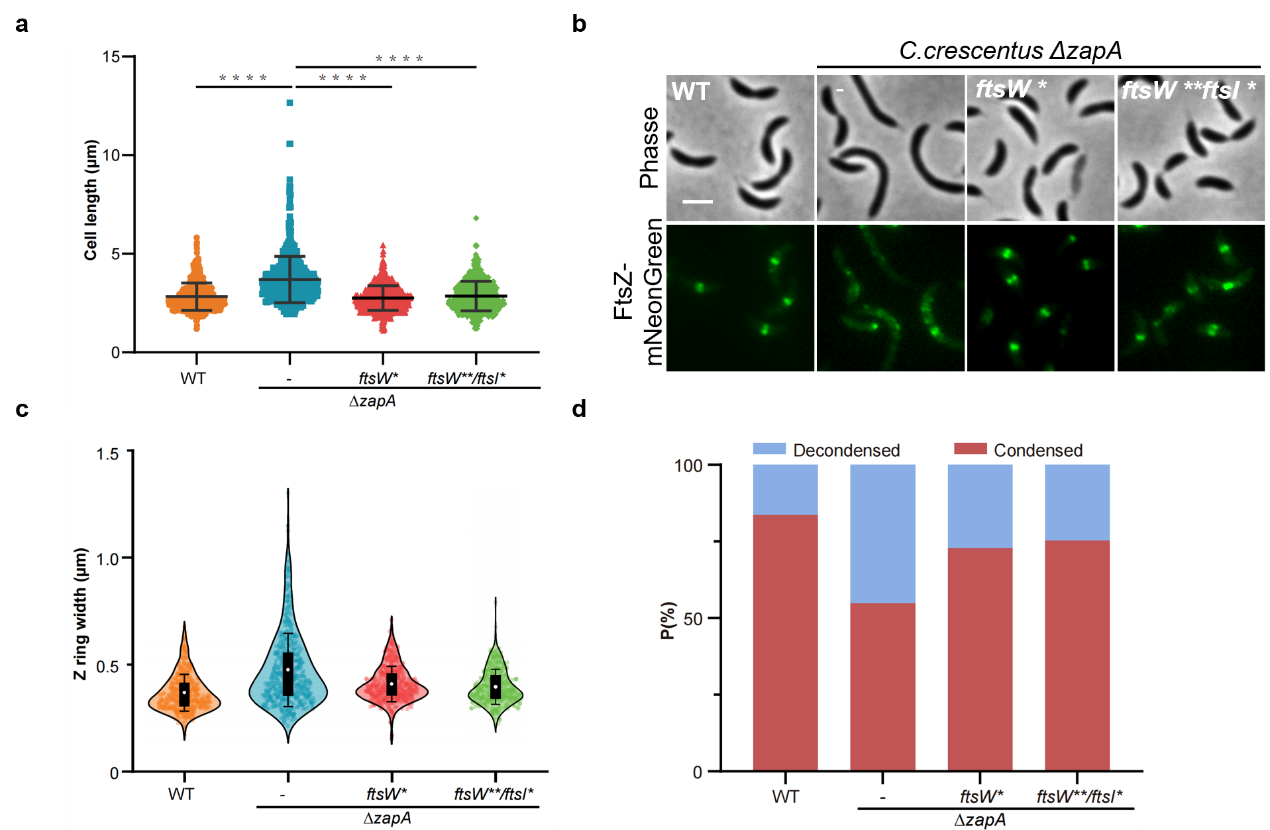
图3. 提高sPG合成促进新月柄杆菌ΔzapA细胞中Z环的凝聚和细胞分裂。
综上所述,该研究发现了Z环凝聚和保持稳定的保守机制,提出了细菌分裂体是一个自我增强的生物大分子纳米机器的新概念(图4),为深入研究细菌的分裂过程提供了新的见解和研究思路。
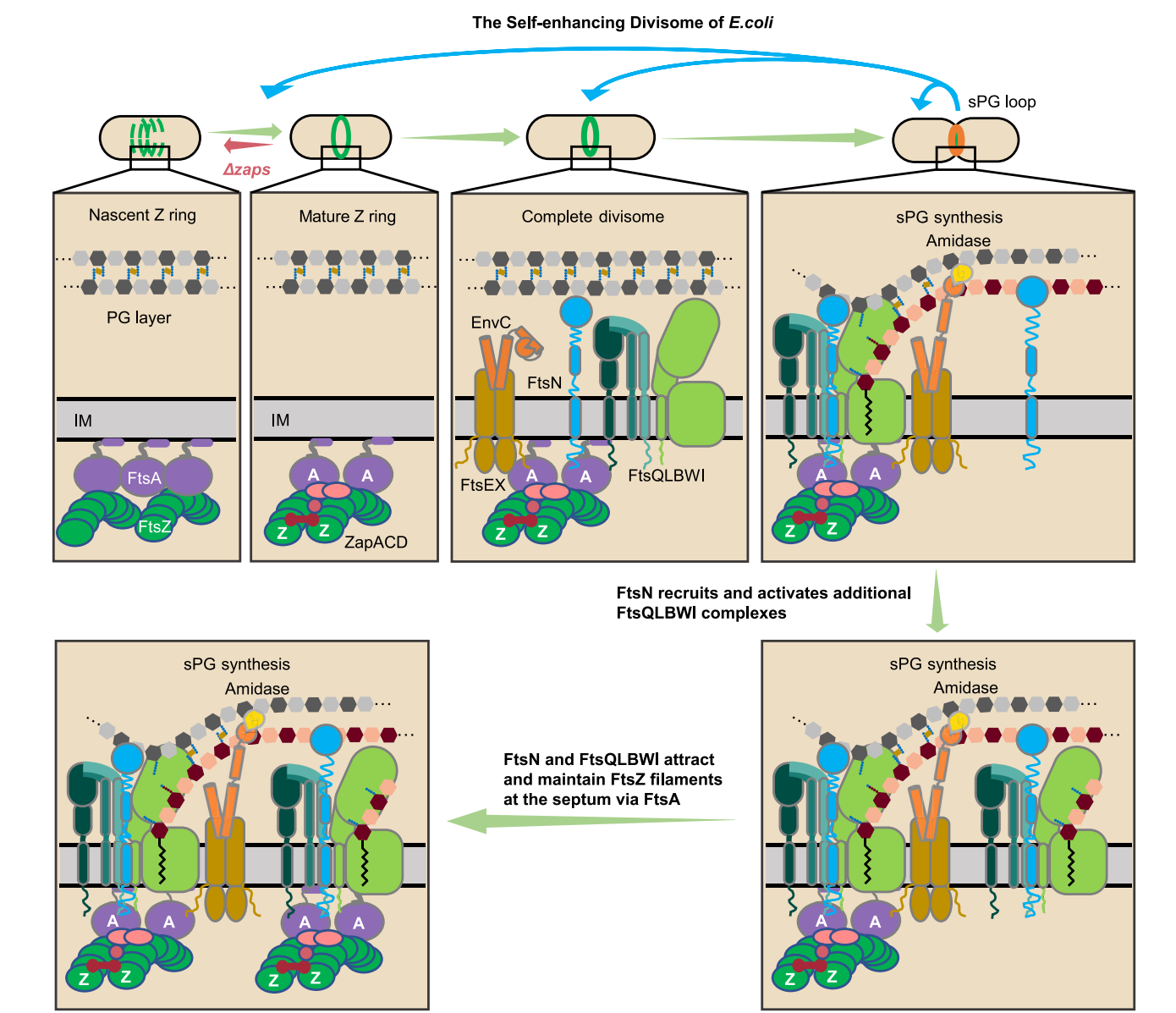
图4. 大肠杆菌分裂体自我增强的作用模型。
武汉大学生命科学学院博士研究生龚晗及中国科学技术大学博士研究生严迪为该论文的共同第一作者,杜世燊研究员与中国科学技术大学杨新星教授为该研究论文的共同通讯作者。武汉大学生命科学学院陈向东教授和美国堪萨斯大学医学中心Joe Lutkenhaus教授为该研究提供了建设性的指导和帮助;美国霍普金斯大学医学院生物化学系Erin D. Goley教授和MIT生物系Michael Laub教授为该研究提供了宝贵的实验材料。该课题得到了国家自然科学基金和中央高校基本科研业务费专项资金的资助。
原文链接:https://www.nature.com/articles/s41467-024-52217-5