(通讯员 杨雪)近日,武汉大学生命科学学院周荣家/程汉华教授课题组在卵巢稳态调控的研究方面取得新进展,其成果在细胞生物学领域国际期刊 Autophagy 在线发表了题目为 RAB37-mediated autophagy guards ovarian homeostasis and function 的研究论文。该项工作揭示了E2F1-EGR2-RAB37协同调控自噬的分子机制,以及维持卵巢稳态及其功能。

卵巢发育是一个复杂的生物学过程,包括卵巢的生长、原始卵泡的增殖和激活、卵泡的发育和成熟以及排卵。正常的卵巢发育及功能维持与个体的终身健康和衰老密切相关。卵巢发育的紊乱会导致不孕症、卵巢早衰和多囊卵巢综合征等疾病。自噬在卵子发生和卵泡发育过程中发挥着重要作用,但维持卵巢自噬稳态的分子机制仍未解析清楚。
课题组前期发现小GTP酶RAB37通过与自噬关键蛋白ATG5直接相互作用,促进ATG5-ATG12-ATG16复合体组装,进而促进LC3B蛋白脂化及自噬体形成 (Cell Death & Differentiation, 2018)。发现了RAB37是调控自噬体形成的组织者。然而该基因在卵巢稳态调控上的功能仍然未知。在该研究中,作者首先建立了卵母细胞条件性敲除小鼠模型,在小鼠卵母细胞中条件性敲除Rab37基因。发现卵母细胞中RAB37的缺失会损害卵泡稳态、干扰激素平衡和卵巢发育,且下调卵巢自噬水平。这说明,RAB37在维持卵巢稳态和发育过程中发挥着重要作用。为了证实RAB37通过自噬调节维持卵巢稳态及功能,进一步通过小分子自噬诱导剂氟桂利嗪上调自噬进而挽救Rab37 敲除小鼠的病理表型。研究发现氟桂利嗪处理能上调Rab37敲除细胞系中的自噬水平。进一步采用氟桂利嗪对Rab37 敲除小鼠进行治疗,发现氟桂利嗪能够上调小鼠卵巢中的自噬水平,且能恢复卵泡发育和激素平衡。为了深入解析RAB37调控卵巢稳态的分子机制,通过对RAB37上游调控机制的研究发现,转录因子E2F1和EGR2是Rab37的转录激活因子,通过上调RAB37的表达进一步促进细胞自噬(图1)。
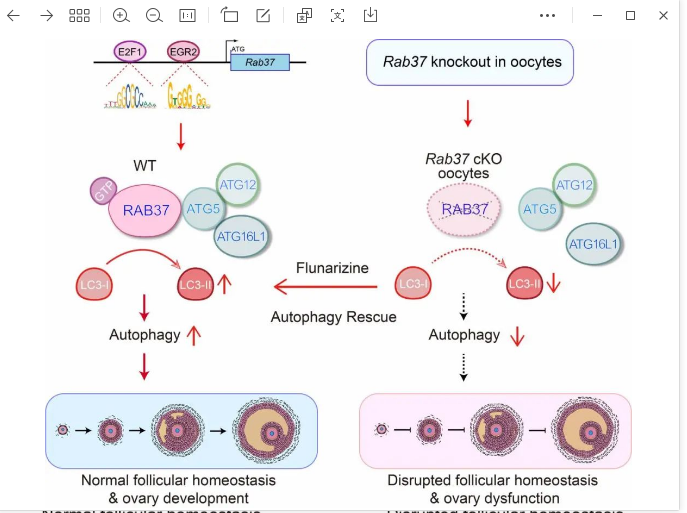
图1. RAB37守护卵巢稳态和功能
综上所述,转录因子E2F1和EGR2协同激活小鼠Rab37的表达,RAB37介导的自噬促进原始卵泡激活并维持卵泡稳态和卵巢功能。通过构建Rab37卵母细胞条件性敲除小鼠,研究发现卵母细胞中RAB37缺失抑制卵巢自噬、损害卵泡活化和稳态,干扰卵巢功能。给予氟桂利嗪治疗上调自噬能挽救卵泡稳态受损和卵巢功能异常,因此RAB37守护着卵泡稳态和卵巢功能。该研究揭示了RAB37介导的自噬调控卵巢稳态和功能,解析了调控卵巢稳态的分子机制。有助于更好地了解卵巢早衰等疾病的发病机理,对维护生殖健康具有重要的医学意义。
武汉大学生命科学学院博士生徐煦和胡萌欣为共同第一作者,武汉大学生命科学学院周荣家教授和程汉华教授以及重庆医科大学侯宇教授为共同通讯作者。
论文链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2024.2389568#d1e423