近日,武汉大学生命科学学院赵海艳团队和中国科学院武汉病毒研究所邓增钦团队合作在Nature Communications上发表题为 Structural and functional insights into the modulation of T cell costimulation by monkeypox virus protein M2 的研究论文。该研究解析了首个痘病毒M2蛋白与人源B7.1(hB7.1)和B7.2(hB7.2)的复合物结构,揭示了猴痘病毒(MPXV)M2蛋白通过结合B7.1/2共刺激分子从而拮抗CD28/CTLA4-B7.1/2信号通路,抑制T细胞激活的免疫逃逸新机制,为痘病毒的防御提供了新的思路。

猴痘是由猴痘病毒(MPXV)感染引起的人畜共患病,2022年5月份以来该传染性疾病在多个国家迅速蔓延,之后被世卫组织宣布为国际关注的突发公共卫生事件。虽然2023年5月起,猴痘不再构成国际关注的突发公共卫生事件,但其感染病例仍在持续增加,2023年7月份我国新增491例猴痘确诊病例。MPXV属于痘病毒科正痘病毒属,是一种砖形或椭圆形,有包膜的DNA病毒,该属还包含能够感染人的牛痘病毒和天花病毒等痘病毒。正痘病毒的基因组约200 kb,编码表达多达200种病毒蛋白,其中多个蛋白参与宿主细胞相互作用,调节细胞的代谢和免疫等反应。对2022年5月新发的猴痘病毒基因测序发现一些毒株出现了大片段的基因重组,包括来自痘病毒免疫逃逸超家族的M2基因拷贝数的增加,暗示M2蛋白可能在猴痘病毒新的传播和致病等特性方面起着重要作用。
经典的T细胞激活信号通路中,抗原呈递细胞表面的B7配体B7.1和B7.2与T细胞表面受体CD28或CTLA4结合,在调节T细胞的激活和耗竭中起着关键作用。多种感染性病原体和肿瘤可以通过调节B7.1/2-CD28/CTLA4信号通路,构建适宜的免疫抑制微环境,以获得更好的复制和存活。
本研究中,作者发现猴痘病毒复制过程中分泌的早期蛋白M2和其他痘病毒的M2蛋白都可以特异性地结合B7家族中的B7.1和 B7.2,而与B7家族中的其他蛋白(B7-H3等)并无明显互作。解析的MPXV M2-hB7.1/2高分辨率复合物结构中M2以同源六聚体和七聚体的环状形式存在,而hB7.1/2以1:1的比例结合在M2蛋白环的外侧(图1)。
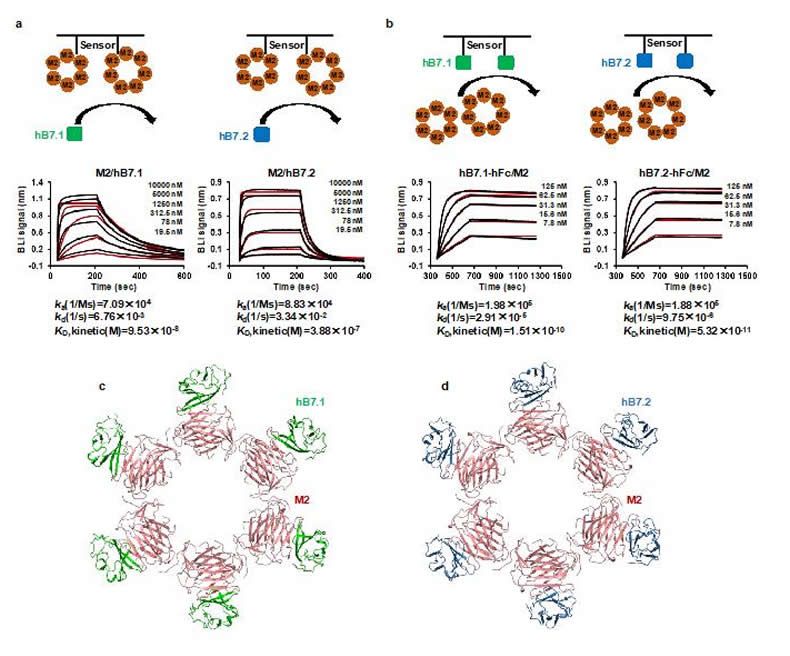
图1. MPXV M2特异性结合抗原呈递细胞表面蛋白hB7.1/2
结构分析发现M2在hB7.1/2的关键结合区域和CD28/CTLA4在hB7.1/2上的结合位点高度重叠,暗示M2可以竞争性地抑制CD28/CTLA4与hB7.1/2的互作。而细胞和竞争性BLI实验也进一步证明M2结合hB7.1/2后可以阻断CD28/CTLA4与hB7.1/2的互作。序列比对发现M2上的互作印记在MPXV分支和其他正痘病毒中高度保守,表明M2可能介导一种保守的免疫逃逸机制,即通过与hB7.1/2的结合来阻断B7配体与CD28家族受体的相互作用从而抑制T细胞激活。有意思的是体外T细胞激活实验发现多聚形式的M2可以有效抑制hB7.1/2共刺激途径介导的T细胞活化,而单体M2与hB7.1/2的亲和力显著变弱,且单体M2几乎丧失了抑制T细胞激活的能力,说明聚集体形式的M2与hB7.1/2的高亲和力结合特性在病毒逃避T细胞免疫反应起着关键作用(图2)。
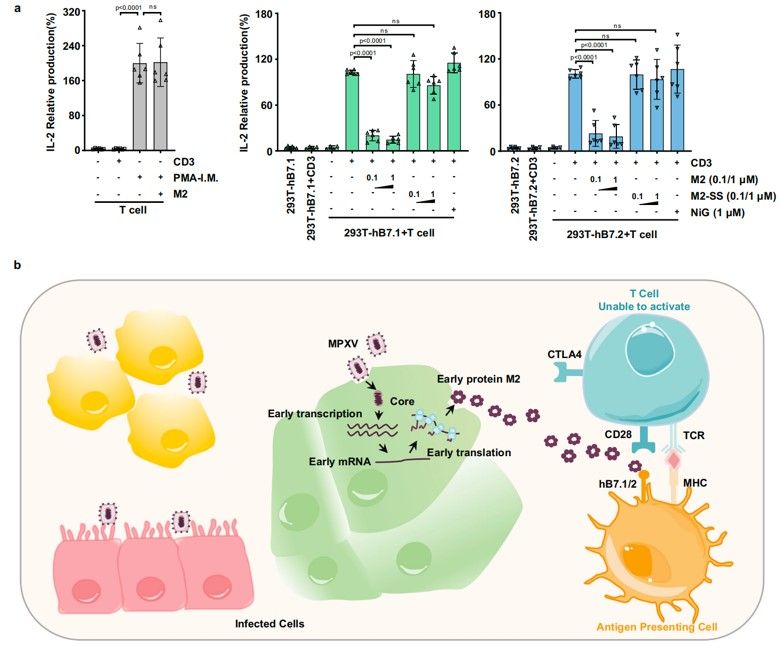
图2. MPXV M2抑制T细胞的激活
综上,该研究首次解析了正痘病毒M2蛋白的结构,揭示了正痘病毒中高度保守的免疫逃逸蛋白M2通过形成多聚体增强其和T细胞协同激活因子hB7.1/2的结合力(avidity),有效地阻断CD28与hB7.1/2互作,从而抑制T细胞活化的病毒免疫逃逸机制。
武汉大学病毒学国家重点实验室/生命科学学院赵海艳研究员和中国科学院武汉病毒研究所邓增钦研究员为该论文的共同通讯作者。武汉大学生命科学学院硕士研究生杨尚予和博士研究生俞飞阳以及中国科学院武汉病毒研究所的博士研究生王咏为论文的共同第一作者。该研究得到了国家重点研发计划项目、国家自然科学基金项目和中国科学院率先行动引才计划项目等的资助。
论文链接:https://www.nature.com/articles/s41467-023-40748-2
来源:病毒学国家重点实验室微信号