近日,武汉大学宋保亮、赵晓璐和华东师范大学仇文卫课题组合作在Cell Research发表了题为《Cholesterylation of Smoothened is a calcium-accelerated autoreaction involving an intramolecular ester intermediate/钙离子促进Smoothened蛋白通过分子内转酯反应形成胆固醇共价修饰》的研究论文,阐明了SMO蛋白的胆固醇修饰是一个由钙离子加速的自发反应,揭示了钙离子在Hedgehog信号转导途径中的重要作用,并证明胆固醇修饰对于SMO功能发挥至关重要【1】。
Hedgehog(Hh)信号通路是一种从果蝇到哺乳动物高度保守的信号通路。Hh通路的信号转导主要由三个蛋白完成——分泌蛋白Hh、Hh受体Patched 1(PTCH1)以及G蛋白偶联受体Smoothened(SMO)。Hh信号通路在胚胎发育和成体器官稳态维持过程中起重要作用,而异常激活的Hh信号通路会引起多种肿瘤。当细胞外Hh浓度升高时,Hh结合PTCH1,解除PTCH1对于SMO的抑制作用,使得定位于细胞内囊泡的SMO转移到初级纤毛,SMO进一步将胞外信号转导至细胞内激活GLI等转录因子【2】。
2017年宋保亮与仇文卫合作首次报道了SMO蛋白被胆固醇共价修饰。人SMO蛋白通过其胞外cysteine-rich domain(CRD)中第95位天冬氨酸侧链羧基与胆固醇3β羟基形成酯键【3】。但SMO蛋白胆固醇共价修饰的化学反应机理和调控机制尚不清楚。
在本工作中,研究人员首先在体外重构了SMO蛋白的胆固醇化共价修饰反应,发现该反应不依赖于额外的能量和其它蛋白,但钙离子能增强胆固醇探针对SMO的共价修饰。进一步质谱分析发现修饰位点D95会首先与临近的Y130侧链形成内酯,钙离子通过促进D95-Y130内酯向D95-胆固醇酯的转酯反应,增强SMO的胆固醇修饰(图1)。
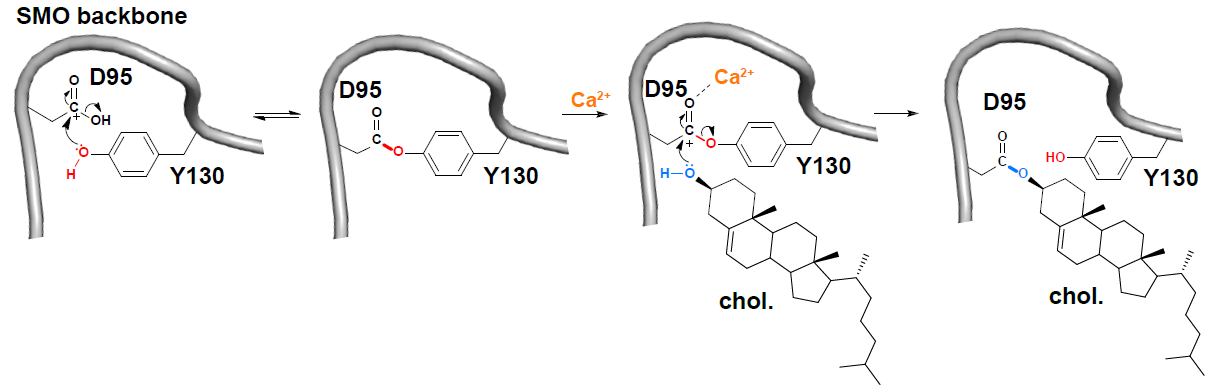
图1. SMO胆固醇化共价修饰的化学反应机理
随后,研究人员发现当细胞受到Hh信号刺激时,SMO早期内体囊泡中的钙离子浓度明显上升。进一步筛选发现Hh信号通过激活STIM-ORAI1钙离子通道介导胞外钙离子内流(图2)。
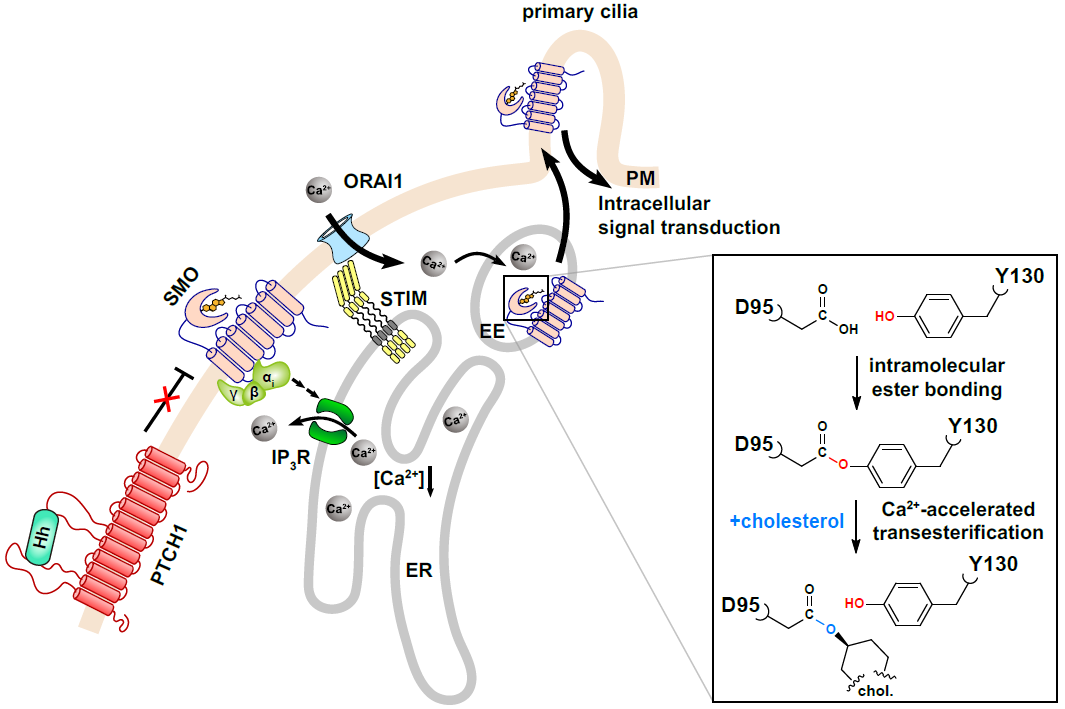
图2. Hh促进SMO胆固醇化修饰的信号转导途径
为探究胆固醇共价修饰对于激活SMO的重要性,研究人员基于SMO结构构建了SMO(D95E)突变。该突变保留SMO结合胆固醇的能力,但不能被胆固醇共价修饰。在细胞水平上,SMO(D95E)突变体极大降低下游Hh信号通路活性。同源位点(SmoD99E)敲入纯合子小鼠表现出严重发育迟缓,导致胚胎致死,说明胆固醇修饰缺失会完全抑制SMO蛋白的活性。
武汉大学高等研究院的胡傲博士和华东师范大学化学与分子工程学院博士研究生张竟赞为本论文共同第一作者。宋保亮教授、赵晓璐副教授和仇文卫教授为通讯作者。该研究工作得到了基金委“生物大分子动态修饰与化学干预”重大研究计划资助。
参考文献
1. Hu A, Zhang JZ, Wang J, Li CC, Yuan M, Deng G, Lin ZC, Qiu ZP, Liu HY, Wang XW, Wei PC, He X, Zhao X, Qiu WW, Song BL. Cholesterylation of Smoothened is a calcium-accelerated autoreaction involving an intramolecular ester intermediate. Cell Research. 0:1–14; https://doi.org/10.1038/s41422-022-00622-0 (2022).
2. Hu A, Song BL. The interplay of Patched, Smoothened and cholesterol in Hedgehog signaling. Curr Opin Cell Biol. 61:31-38 (2019).
3. Xiao X, Tang JJ, Peng C, Wang Y, Fu L, Qiu ZP, Xiong Y, Yang LF, Cui HW, He XL, Yin L, Qi W, Wong CC, Zhao Y, Li BL, Qiu WW, Song BL. Cholesterol Modification of Smoothened Is Required for Hedgehog Signaling. Mol Cell. 66(1):154-162 (2017).
附件:  原文下载.pdf
原文下载.pdf