2023年5月8日,《美国科学院院报》(PNAS)在线刊发了武汉大学生命科学学院、泰康生命医学中心陈学峰教授课题组的最新研究进展,论文题目为 “The RPA-RNF20-SNF2H cascade promotes proper chromosome segregation and homologous recombination repair” (doi: 10.1073/pnas.2303479120)。

细胞基因组稳定性的维持依赖于精确的染色体分离和DNA 修复调控机制。这些过程发生错误会导致基因组不稳定性,引起细胞发生癌变或死亡。过去国内外的研究发现肿瘤抑制因子RNF20介导的组蛋白H2B泛素化修饰(H2Bub)对于促进正常染色体分离和DNA修复过程具有重要作用。但是,H2Bub调控染色体精准分离的分子机制并不清楚。此外,作为一种独立的表观遗传修饰,H2Bub是如何响应染色体分离和DNA修复这两个生物学过程的尚不清楚。
课题组前期在模式生物酿酒酵母中发现DNA修复蛋白RPA通过招募介导H2Bub的E3连接酶Bre1(RNF20的酵母同源蛋白)至DNA复制或断裂位点,刺激局部染色质上的H2Bub,从而促进DNA复制和修复过程(Liu et al.,PNAS, 2021)。在此项研究中,该课题组发现该机制在哺乳细胞中具有保守性。发现RPA与RNF20在体内外存在相互作用,并将RNF20招募至着丝粒以及DNA断裂处。一方面,RPA将RNF20招募至染色体着丝粒处,通过刺激着丝粒处H2Bub、H3K4me2以及SNF2H的富集,进而促进Aurora B激酶的激活,从而调控动粒-微管连接过程,确保染色体的正确分离。另一方面,该项研究发现RPA与RNF20的相互作用还促进RNF20在DNA损伤处的募集,进而刺激局部染色质上的H2Bub,促进同源重组修复过程。特异性破坏RPA与RNF20之间的相互作用会导致有丝分裂异常比例上升、同源重组缺陷以及对DNA损伤药物敏感等系列严重后果。在结合文献报道基础上,该研究揭示了细胞内存在RPA-RNF20-SNF2H轴,发挥调控染色体分离和同源重组修复这两个生物学过程的双重作用。该项研究回答了H2Bub修饰是如何响应有丝分裂和DNA损伤修复这一重要科学问题,揭示了RPA具有控制表观遗传修饰的染色质时空分布这一重要功能,对于全面解析肿瘤抑制因子RNF20/RNF40复合物在维护基因组稳定性以及肿瘤发生发展过程中的作用与机制具有重要意义。
生命科学学院20级博士研究生李济民为论文第一作者,陈学峰教授为论文通讯作者,武汉大学为第一作者单位。研究生赵婧宇、甘晓丽、王岩岩和姜董豪参与了该项研究工作。此外,该项工作还得到了武汉大学陈亮教授、南京大学附属鼓楼医院许景艳教授、乔治华盛顿大学裴华东教授和浙江大学黄俊以及汪方炜教授的支持。据悉,该项研究工作得到了国家重点研发计划项目、国家自然科学基金面上项目和武汉大学泰康生命医学中心的经费支持。
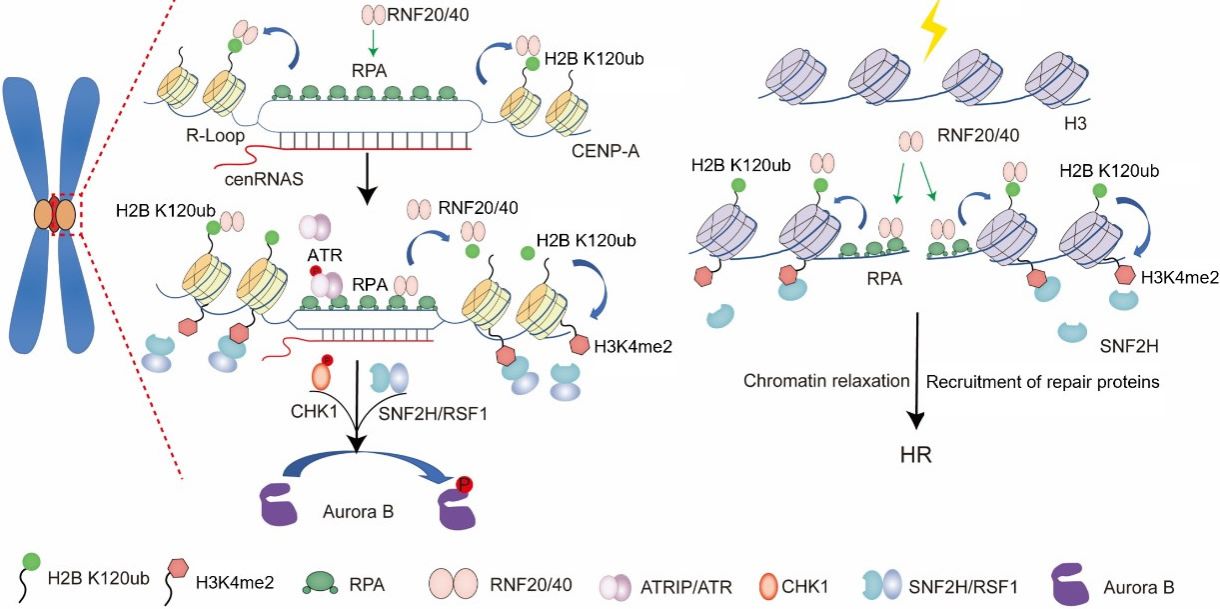
图1:RPA-RNF20-SNF2H信号通路促进正常的染色体分离和同源重组修复