2023年5月5日,武汉大学生命科学学院赵华斌教授团队于Science Advances期刊发表了题为“Comparative analyses of bat genomes identify distinct evolution of immunity in Old World fruit bats”(蝙蝠基因组的比较分析揭示了旧大陆果蝠免疫基因的独特进化)的研究论文。武汉大学生命科学学院博士生田仕林和曾嘉鸣为论文的共同第一作者,赵华斌教授为论文的通讯作者。

图1. 相关论文在线发表于Science Advances
蝙蝠是多种人畜共患病毒的天然宿主,能够无症状地携带多种导致其它哺乳动物致病的烈性病毒。因此,蝙蝠已经演化出独特的免疫系统来应对病毒感染。其中,狐蝠科蝙蝠(旧大陆果蝠)被认为是引起国际公共卫生组织关注的多次病毒大流行事件中高致病性病毒(如亨德拉病毒、马尔堡病毒和埃博拉病毒)的天然宿主,研究其免疫系统演化机制对人类制定病毒防控和抗病毒治疗策略具有重要的意义。
赵华斌团队采用比较基因组学分析手段研究了狐蝠科蝙蝠免疫系统的谱系特异性演化规律。研究团队组装了一种广泛分布于南亚和东南亚的狐蝠科代表食果蝙蝠犬蝠(Cynopterus sphinx)的染色体级别的基因组,并将它作为比较基因组分析的参考基因组。犬蝠在国内主要分布于西藏、广东、广西、海南和云南等地(图2),也是β-GX2018病毒株的无症状宿主,这种病毒株与已造成国际大流行的多种冠状病毒(如MERS-CoV、SARS-CoV和SARS-CoV-2)同样属于β-冠状病毒。

图2. 犬蝠图片(Cynopterus sphinx)
图片来源于:Bats in China (University of Bristol),
http://www.bio.bris.ac.uk/research/bats/China%20bats/
不同于当前常规的两步法组装流程(先组装后染色体挂载),研究团队开发了一种优化的四步法基因组组装策略,并完成了一个连续性和完整性最好的蝙蝠基因组序列(图3)。该流程利用了染色质互作数据(Hi-C)预先对具有潜在连接关系的Nanopore长序列进行聚类,有效地去除了组装过程中构建序列串图(string graph)时的远距离重复序列的嵌合连接。利用此组装策略,组装的犬蝠基因组大小为1.86 Gb,Contig N50值为84.24 Mb,并实现了犬蝠4条染色体序列的无缺口(Gap-free)组装。
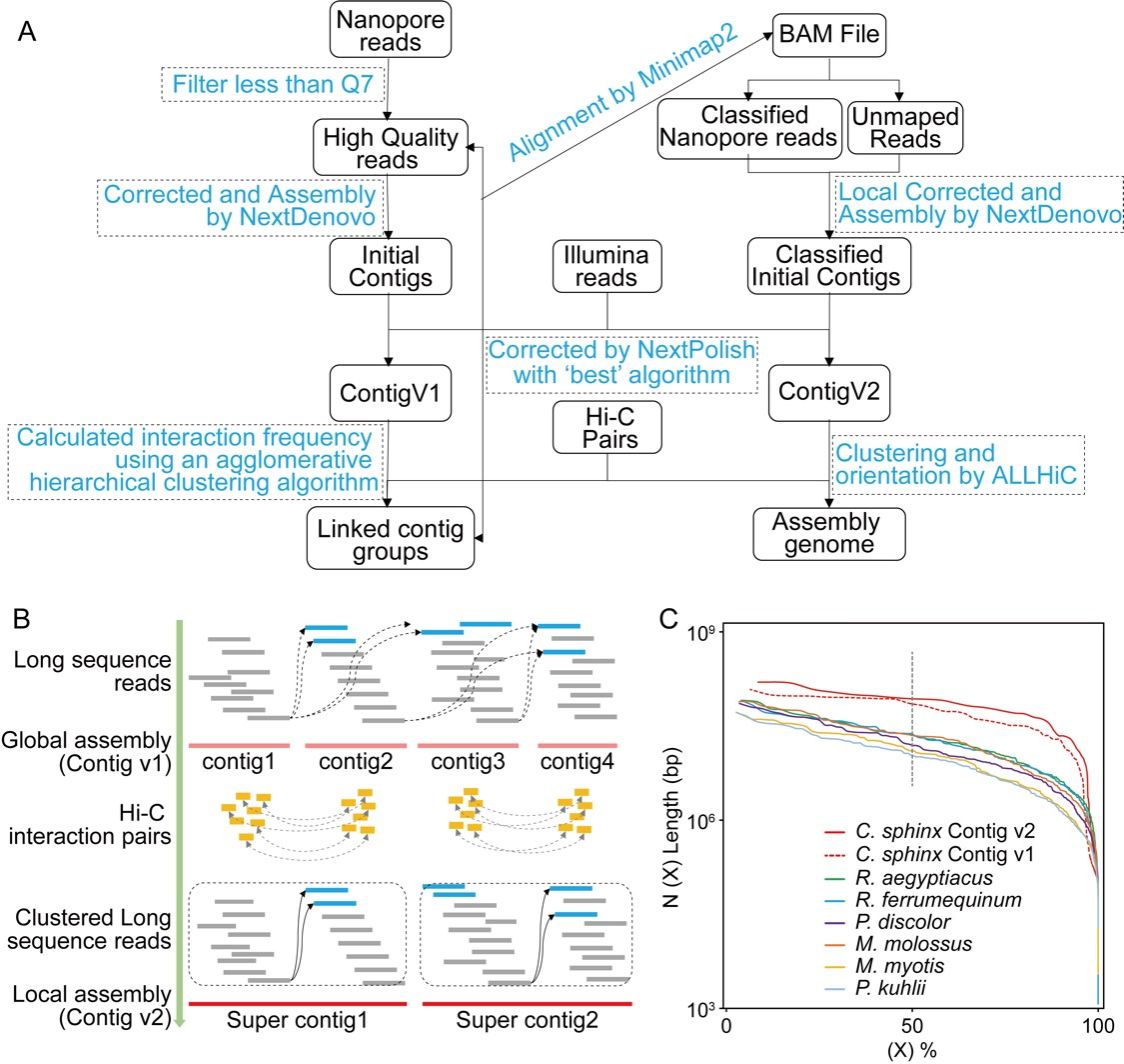
图3. 基因组组装流程示意图和染色体级别的蝙蝠基因组质量比较图
接着,研究团队阐述了狐蝠科蝙蝠免疫基因的谱系特异性演化规律(图3)。本研究选取了6种食果蝙蝠作为狐蝠科谱系代表,并与其它5种蝙蝠以及7种其它哺乳动物进行比较基因组学分析,发现诸多狐蝠科蝙蝠谱系特异的遗传改变,包括炎性小体基因NLRP1的丢失、肽聚糖识别基因PGLYRP1和补体受体C5AR2的复制,以及一种toll样受体(TLR)信号传导中的关键衔接分子MyD88的4个能改变氨基酸理化特性的特异性突变。研究结果还揭示了狐蝠科蝙蝠的免疫基因表现出更高的进化速率和经历了更强烈的正向选择压力(图4)。

图4. 狐蝠科蝙蝠免疫基因的谱系特异的分子适应机制
最后,研究团队通过细胞实验证实了狐蝠科MyD88的特异性适应性突变有利于其在应对病毒感染时系统性地下调免疫反应(图5)。通过在狐蝠Paki细胞系中进行免疫共沉淀实验(Co-IP),证实了MyD88蛋白的特异性突变降低了其与toll样受体TLR2的结合亲和力。接着,还分别在狐蝠Paki细胞系和人类PEAKrapid细胞系中进行了基因过表达实验,证明了MyD88蛋白的特异性突变减弱了其对TLR2依赖性炎症因子的诱导。
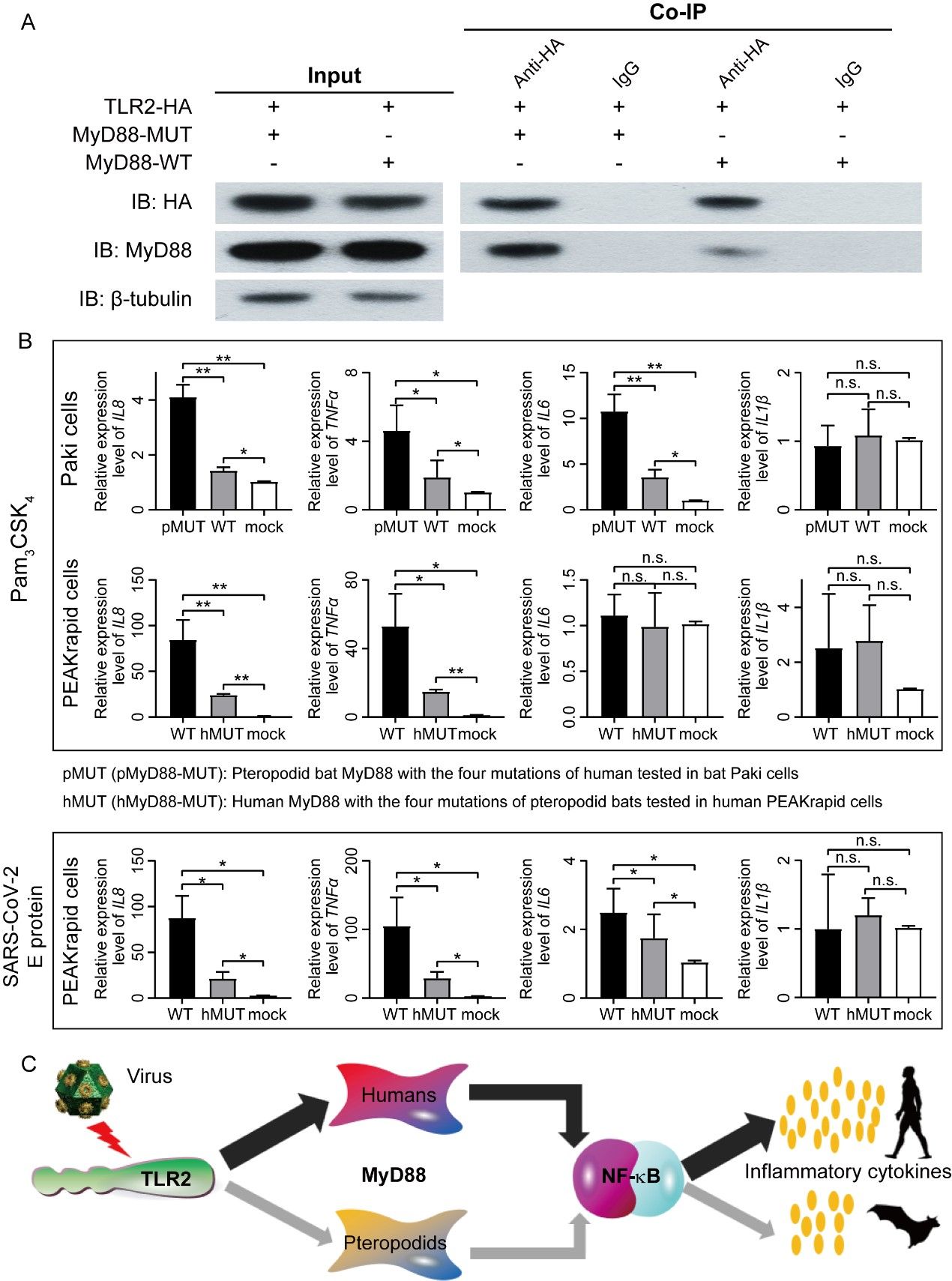
图5. 狐蝠科蝙蝠MyD88特异性突变抑制炎症反应的实验证据
综上所述,该研究揭示了狐蝠科蝙蝠的免疫系统演化出了独特的免疫基因演化机制,这可能是狐蝠科蝙蝠能够成为无症状人畜共患病毒宿主的重要原因之一。该研究提示,蝙蝠多样性非常丰富,其免疫基因的演化模式可能比之前想象的更加复杂多样。此外,该研究还展示了狐蝠科蝙蝠作为未来免疫研究模型的潜力,高质量的犬蝠基因组将有助于建立用于蝙蝠免疫学研究的圈养繁殖群。
原文链接:http://www.science.org/doi/10.1126/sciadv.add0141