2023年1月4日(当地时间),武汉大学生命科学学院、病毒学国家重点实验室蓝柯、徐可课题组在Science Translational Medicine以长文(Research Article)形式联合发表了研究论文“Vaccination with Span, an antigen guided by SARS-CoV-2 S protein evolution, protects against challenge with viral variants in mice”,研究提出了应对新冠病毒不断变异的广谱疫苗设计新策略。

新型冠状病毒(SARS-CoV-2)引起的疫情仍在持续,迄今全球新冠病毒感染者已达6亿4千多万人次,死亡约660余万人(据世界卫生组织官网)。随着病毒传播与流行的时间越长,病毒不断积累变异,加上人体免疫以及疫苗免疫的选择压力,新冠病毒已由最初的原始毒株进化出多谱系的变异毒株。世界卫生组织将重要变异病毒命名为重点关注变异株(variant of concern, VOC),包括:阿尔法(Alpha)、贝塔(Beta)、伽马(Gamma)、德尔塔(Delta)和奥密克戎(Omicron)。
然而,与病毒变异速度不匹配的是疫苗研发需要漫长的周期,目前上市的大部分疫苗(灭活疫苗、亚单位疫苗、核酸疫苗、病毒载体疫苗等)仍以新冠病毒原型株为抗原,对现在流行的Omicron及其亚系毒株的中和能力均有不同程度的下降。即便疫苗企业可以根据流行毒株变化更新疫苗,也往往会滞后于病毒变异的速度。因此,如何研发一种既能对抗当下流行毒株、又能对抗未来可能出现的变异流行株的相对广谱的疫苗,是一个重要的科学问题。
研究人员通过追踪新冠病毒刺突蛋白(S蛋白)的进化和突变规律,提出了“基于病毒进化共识序列,优化设计疫苗免疫原”的广谱疫苗设计新策略,研发了一种覆盖“共性突变”的广谱疫苗免疫原Span(泛新冠病毒S抗原),可诱导产生针对阿尔法(Alpha)、贝塔(Beta)、伽马(Gamma)、伊塔(Eta)、卡帕(Kappa)、德尔塔(Delta)、拉姆达(Lambda)和奥密克戎(Omicron)及其亚系在内的广谱中和抗体,保护实验小鼠抵抗包括Omicron在内多种新冠病毒变异株的致死性攻击(图1)。
图1. Span疫苗效果科普图
广谱疫苗免疫原(Span)如坚固的城堡抵御多种新冠病毒变异株
该研究首次报道了新冠病毒的进化路径,发现在人群中存活下来的病毒分离株中,新冠病毒刺突(Spike,S)蛋白的突变并不是完全随机的,而是沿着三条定向路径进化(图2)。
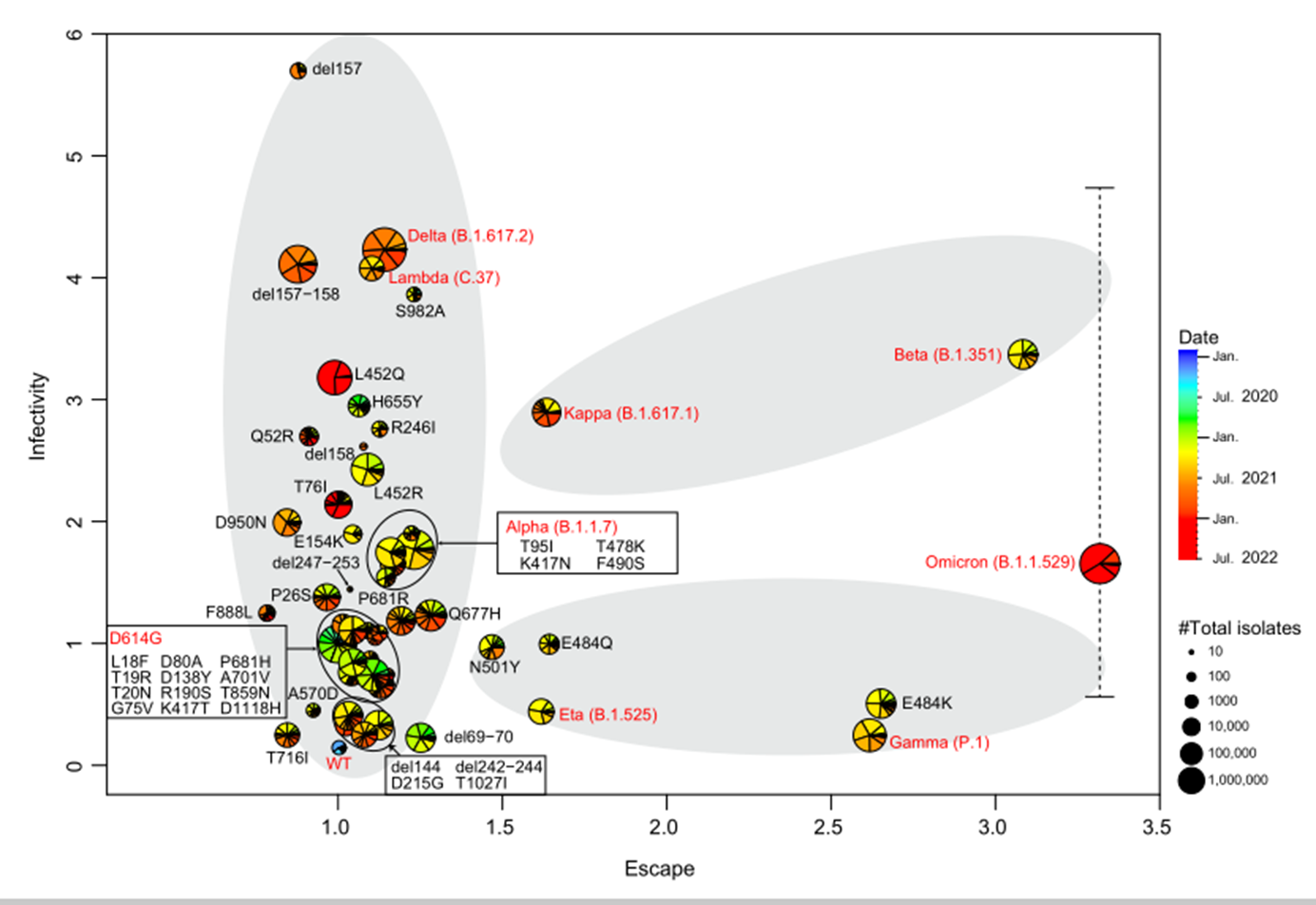
图2. 新冠病毒S蛋白的进化规律(包含11,650,487条序列)
x轴表示SARS-CoV-2变种的免疫逃逸能力,y轴表示SARS-CoV-2变种的细胞感染性。扇面颜色标志着GISAID数据库中记录的所示变体的分离时间。每个扇区的面积大小表示截至到2022年7月(每个月)分离的单个变异株的数量。灰色阴影表示进化路径。
S蛋白突变的路径不同导致了抗原性的改变。因此,单一毒株的疫苗成分无法有效保护人群对抗不同进化路径上的其它变异株。为了获得一个能够覆盖绝大多数变异株的广谱免疫原,研究团队分析了NCBI数据库中的2675条新冠病毒S蛋白序列,通过进化聚类(图3A),计算所有突变位点的发生频率(图3B),最终设计了一种覆盖共性突变的拟合新抗原(Span)(图3C)。结果表明,Span序列位于S蛋白系统发育树的中心位置(图3D)。

图3. Span位于系统发育树中心位置
非常有意思的是,Span在Delta和Omicron流行暴发前就已设计完成,但其覆盖了进化计算得到的共性突变,代表了S蛋白突变的趋同规律,因此与后来出现的Omicron聚类到一起,说明Span具有覆盖未来变异株的潜力(图3E)。进一步分析证明,研究团队得到的上述6个共性突变位点在后来爆发的Omicron亚系毒株中均保留,显示出很强的共性规律和预见性(图4)。
上述共性突变位点和广谱疫苗抗原设计方案已于2022年8月5日获中国发明专利授权(专利名称:新型冠状病毒突变株S蛋白及其亚单位疫苗;专利号:ZL 2021 1 1181856.X)。
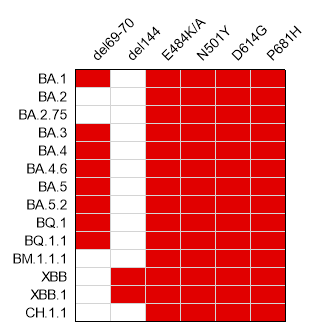
图4. 研究团队发现的6个共性突变位点(横向标记)在后来爆发的Omicron流行株(纵向标记)中均有很大程度的保留(红色表示该位点保留)。
与设计预期相符,研究团队发现Span免疫原相比于原型株免疫原(Swt)展现出明显的广谱中和优势:在免疫2针原型株S蛋白再加强免疫1针Span蛋白后,与免疫3针原型株S蛋白相比,Span诱导出针对WT、Beta、Delta、Omicron毒株及其亚系更高效的、广泛的中和抗体(图5A,图5B),并能100%保护小鼠免受Omicron毒株的致死性攻击(图5C)。这说明,Span作为加强针能提供广谱保护。即便是单纯的2针Span免疫,也可以提供跨谱系的交叉免疫保护,同时抵抗WT、Beta和Delta毒株的致死攻击。研究人员也观察到,原型株免疫原(Swt)是无法提供跨Beta毒株的有效交叉保护的。该研究工作对这一创新的广谱疫苗设计构想进行了概念性验证(Proof of Concept),基于新冠的共性进化规律设计的泛新冠病毒S蛋白免疫原(Span)有望成为预防新冠病毒现有及未来潜在流行株的广谱候选疫苗。

图5. Span疫苗免疫在小鼠体内提供了广谱性免疫保护作用。
武汉大学生命科学学院、病毒学国家重点实验室蓝柯教授和徐可教授为该论文的共同通讯作者。病毒学国家重点实验室赵永亮博士后、武汉大学生命科学学院博士生倪文佳、梁斯萌、董良辉、向敏、牛丹萍、武汉大学动物三级生物安全实验室实验师蔡曾博士为论文共同第一作者。该研究得到了国家自然科学基金、湖北省创新团队、武汉大学新冠肺炎专项研究基金、北京泰康溢彩公益基金会的资金资助。
论文链接:
https://www.science.org/doi/10.1126/scitranslmed.abo3332