2022年10月20日,《Advanced Science》在线刊发了武汉大学生命科学学院、病毒学国家重点实验室姚镜教授课题组的研究进展,论文题目为“The transient receptor potential vanilloid 2 (TRPV2) channel facilitates virus infection through the Ca2+-LRMDA axis in myeloid cells”(瞬时受体势香草素 2 (TRPV2) 通道在髓系细胞中通过Ca2+-LRMDA 信号轴促进病毒的感染)。

TRPV2通道在神经组织和非神经组织中广泛分布,对Ca2+具有高选择通透特性,虽已发现它在不同组织中发挥复杂多样的功能,但其在髓系免疫细胞中的功能尚不明确。在本课题中,研究人员首先发现TRPV2通道在小鼠骨髓来源的树突状细胞(Bone Marrow-Drived Dendritic Cells, BMDCs)和巨噬细胞(Bone Marrow-Drived Macrohages, BMDMs)中大量表达,且具有良好的离子通道活性。课题组利用CRISPR-Cas9技术构建了髓系特异性敲除Trpv2的小鼠(Lyz2-Cre;Trpv2fl/fl),发现敲除TRPV2或利用SKF96365抑制TRPV2通道活性显著抑制多种病毒的感染,如HSV-1、SeV、IAV与VSV等,延长HSV-1或VSV感染后小鼠的生存期,表明TRPV2在细胞与小鼠水平促进病毒感染。在Trpv2基因敲除细胞中表达TRPV1(该通道蛋白在髓系细胞中不表达)或恢复表达TRPV2,可促进病毒的感染,而回补TRPV1D646N-E648/651Q或TRPV2E572Q(钙离子非通透的突变)则显著抑制病毒感染,表明TRPV2促进病毒感染的过程依赖于其离子通道活性。
进一步,研究人员发现TRPV2通道在调控巨噬细胞和树突状细胞内的Ca2+稳态中具有重要功能,Trpv2基因的缺失或对TRPV2通道活性的抑制使得细胞内的Ca2+浓度下降,Ca2+浓度的下降会下调一种与细胞骨架蛋白相互作用的Lrmda基因的表达,进而破坏细胞膜的张力与流动性,从而抑制病毒的入侵。与此观察相一致的是,直接敲低Lrmda基因的表达也能够限制病毒对细胞的感染;而如果在Trpv2基因缺失的细胞中回补Lrmda可部分恢复细胞膜的张力与流动性,以及病毒的入侵。综上,本研究对TRPV2-Ca2+-LRMDA信号轴在病毒侵染髓系细胞中的作用机制进行了解析,为抗病毒感染提供了新的策略。
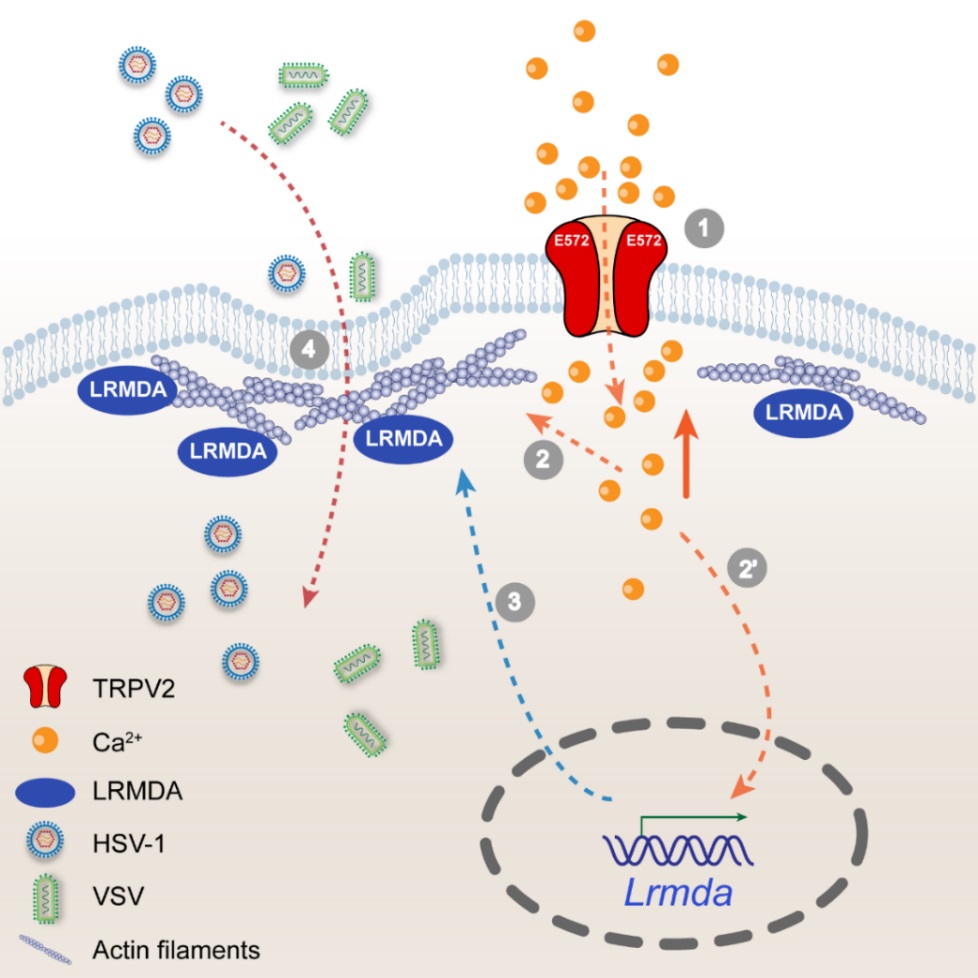
TRPV2-Ca2+-LRMDA信号轴在髓系细胞病毒感染过程中的作用示意图
武汉大学生命科学学院2019级博士研究生高悦与2022级博士研究生郭钰尧为本研究的共同第一作者,姚镜教授和中南医院/医学研究院张志东博士为该论文的共同通讯作者,高级实验师谢畅,硕士研究生赵雨寒、江德祥、王宇霖,博士研究生张由婧、胡钰茹、甘胡等也参与了研究。该研究工作得到了生命科学学院/医学研究院钟波教授、高等研究院刘郑教授和中国科学院武汉病毒研究所崔宗强研究员的大力协助。国家自然科学基金、科技部重点研发计划、湖北省自然科学基金和中央高校基本科研业务费专项资金等项目给予研究资助。
论文链接:http://doi.org/10.1002/advs.202202857