2024年12月,国际知名杂志International Journal of Biological Macromolecules在线发表武汉大学生命科学学院郑忠亮副教授课题组的最新研究成果。论文题为“Increased thermal stability and catalytic efficiency of 3-ketosteroid Δ1-dehydrogenase5 from Arthrobacter simplex significantly reduces enzyme dosage in prednisone acetate biosynthesis”。武汉大学生命科学学院硕士生张蓉作为第一作者,郑忠亮副教授为唯一通讯作者。

该研究报道了来自简单节杆菌的3-甾醇-Δ1-脱氢酶5(KsdD5)催化醋酸可的松(CA)转化为醋酸泼尼松(PA)的应用。研究人员采用计算机辅助筛选,结构分析和组合实验来筛选并鉴定具有稳定性和活性位点双重优势的KsdD5工程突变体(M1和M3)。M1的半衰期(30 ℃下19.6 h)是WT的8.2倍,T15min 50提高11.8 ℃,Tm提高10.6 ℃。M3的催化活性是WT的3.82倍,30 ℃下的半衰期是WT的3.9倍,T15min 50和Tm分别比WT高14 ℃和6.9 ℃。此外,动力学常数和微量热泳分析表明,M3由于其更大的酶通道而表现出更高的催化效率。分子动力学模拟表明,M1促进更紧密的二级结构堆叠,减少残基的灵活性,并增加氢键的形成,确保酶在高温下的稳定性和活性。在工业条件下(底物浓度60 g·L-1,菌泥用量6 g·L-1),M1和M3在30 ℃下12小时内的转化率分别达到96%和95%。这项研究证明了一个有效理性设计策略,开发出高效突变体,使用目前最小的酶剂量进行可持续性的PA工业生产。
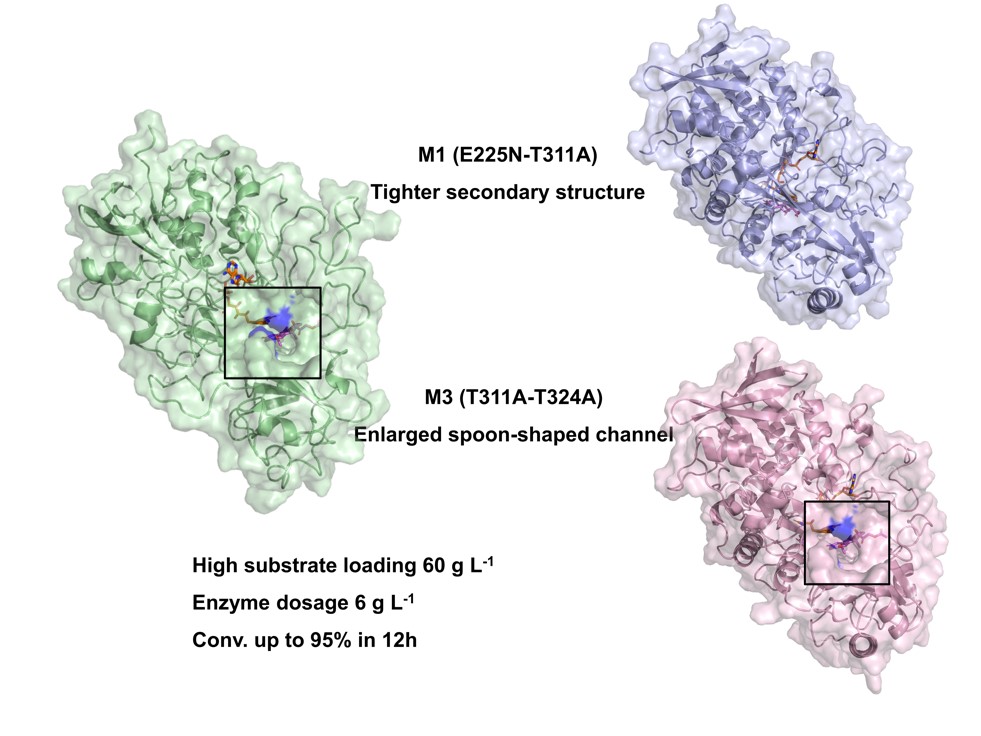
图1. KsdD5突变体理性设计及其在PA高效转化中的应用
开发提升稳定性和活性的组合策略
利用AlphaFold2、Autodock Vina和Amber22构建了KsdD5-FAD-CA复合物的同源模型。随后采用了一种整合了计算机辅助筛选(包括PROSS、Rosetta_Cartesian、Foldx)、结构分析(底物通道扩大)和实验验证的组合策略,鉴定出9个热稳定性和活性高于KsdD5的潜在突变体,形成了一个小文库,其中T311A、E225N在热稳定性有显著提升,T324A则是极大提高了底物催化效率。进而将优势突变相结合,筛选出多种具有优异性能的突变体M1和M3。对筛选出的突变体进行了热稳定性测试和酶催化活性测定。用半衰期、半失活温度、熔断温度等指标对突变体进行了热稳定性评估。同时,酶动力学常数测定与MST结合常数分析验证了其催化效率的显著提高。
扩大底物通道提升蛋白酶催化效率
研究人员改变底物出入口的空间位阻来提高底物催化速率,图2显示了野生型KsdD5勺匙状通道的匙柄顶部的残基V152和底部的残基T324侧链的氢原子之间的距离由5.1和6.1 Å分别增加至7.0和6.3 Å。在酶动力学常数测试中,T324 A的kcat·Km-1显著增加至399.45 min-1·mmol-1·L,几乎是野生型的3倍,M3突变体(T311A-T324A)表现出最高的kcat·Km-1,达到461.63 min-1·mmol-1·L,几乎是野生型的4倍,这一提升意味着酶的催化效率显著增强。MST测定酶和底物之间的Kd,其反映了酶和底物在动态平衡状态下的结合强度,Kd值越高,表明活性位点的结合越弱,底物交换速率越高。T324A和M3的Kd分别是KsdD5-WT的30.1倍和28.7倍。T324A突变改变了底物进入结合位点的途径,使底物更容易与活性位点结合,从而降低了Km值。然而,结合位点构象较为灵活,导致Kd值较高。扩大的通道结构降低了底物的进出阻力,使底物更快、更灵活地定位在活性位点,从而加速了催化循环,提高了kcat。
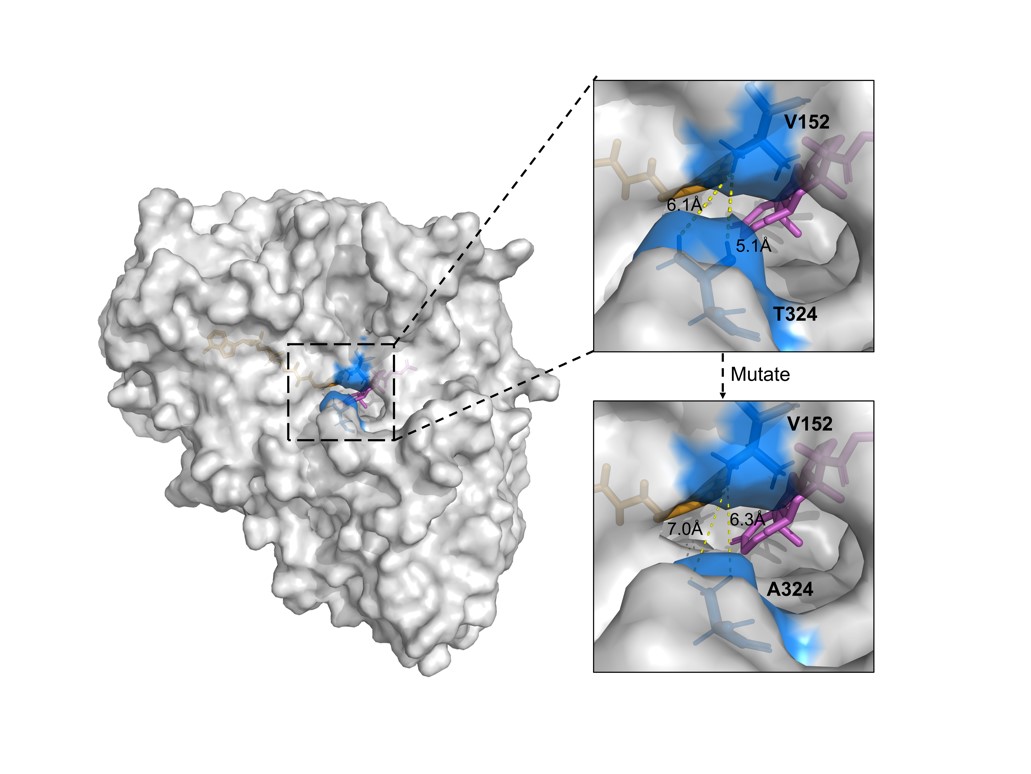
图2. KsdD5底物通道扩大模型。蓝色表示从Thu突变为Ala; FAD为橙色,CA为粉色。
热稳定性提升机制分析
运用圆二色谱进行蛋白热变性实验分析二级结构变化,并运用MD模拟进行分子机制研究。CD结果表明,突变体T311A、M1和M3的功能二级结构(α螺旋和β折叠)在30 ℃加热4 h后基本保持不变,这解释了它们在该温度下的高稳定性和活性。相比之下,WT在相同条件下表现出α螺旋和β折叠含量的显著降低,表明二级结构的显著降解,导致酶活性的显著损失。
进一步在分子水平上研究突变体结构稳定性机制,在30 ℃下对KsdD5-WT及其突变体进行了100ns的MD模拟。由图3所示,三种突变体表现出较低的RMSD,并且在100 ns时间段内比KsdD5-WT更快地达到稳定状态(图3A)。反映单个氨基酸残基活性的RMSF在突变体中总体上显著降低,特别是在残基48-117、205-260、320-381和410-478处(图3B)。Rg与整体蛋白质结构稳定性相关。突变体T311A、M1和M3表现出比KsdD5-WT更低和更稳定的Rg值(图3C)
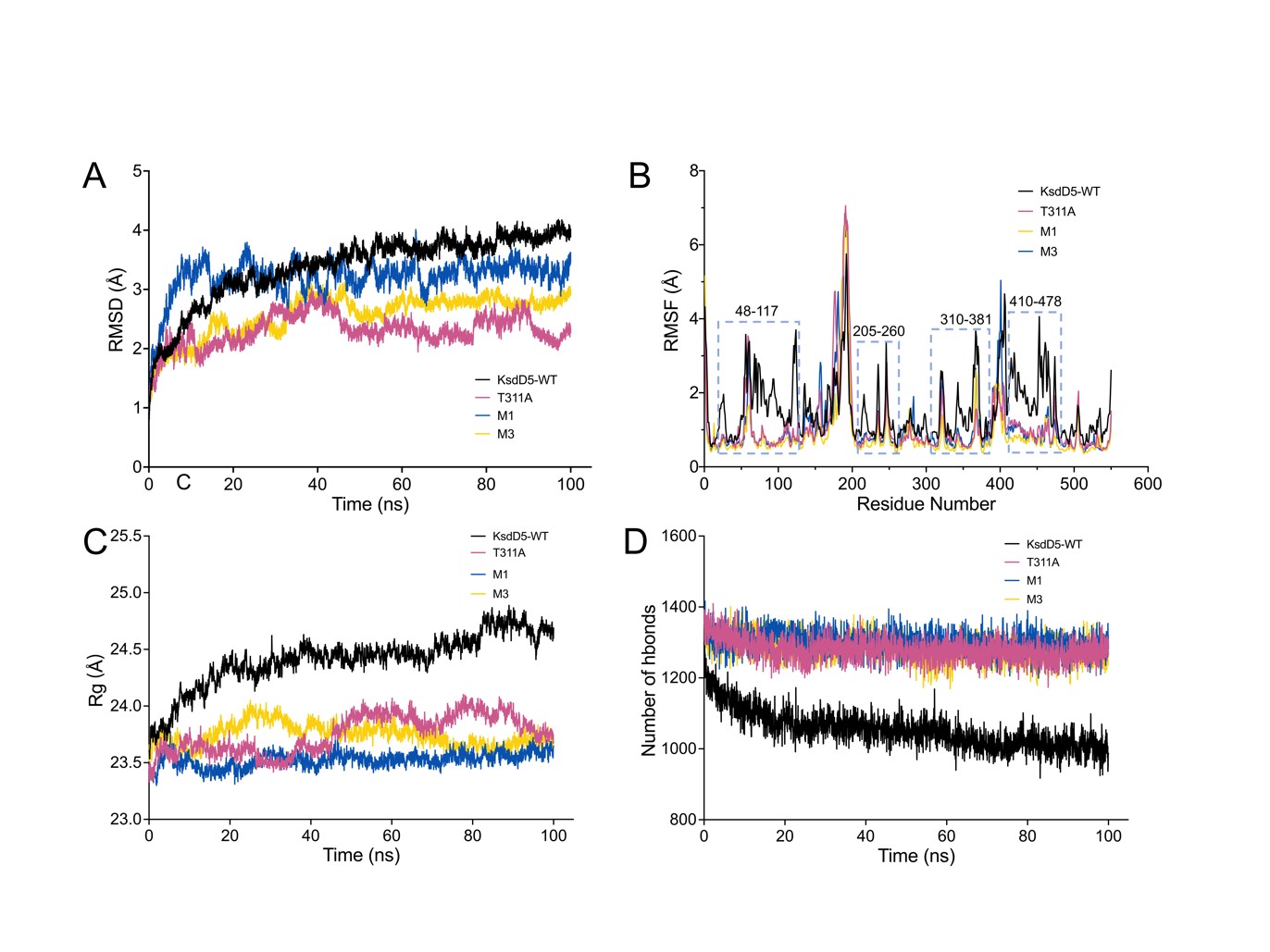
图3. WT及其突变体在MD模拟100ns后进行结构热稳定性的分子机制分析(A)RMSD、(B)RMSF、(C)Rg和(D)氢键数量
DSSP二级结构时序分析表明在30 ℃下100ns加热过程中突变体在具有较低RMSF值的区域内保留了更多的α螺旋和β折叠(图4中以黑色圆圈突出显示),而WT二级结构在加热过程中显著降解。此外,与WT相比,T311A、M1和M3中的模拟终状态下的氢键(在3 Å内)的数量分别增加了281、297和280个(图3D),这有助于整体上形成更紧凑和稳定的蛋白质结构。
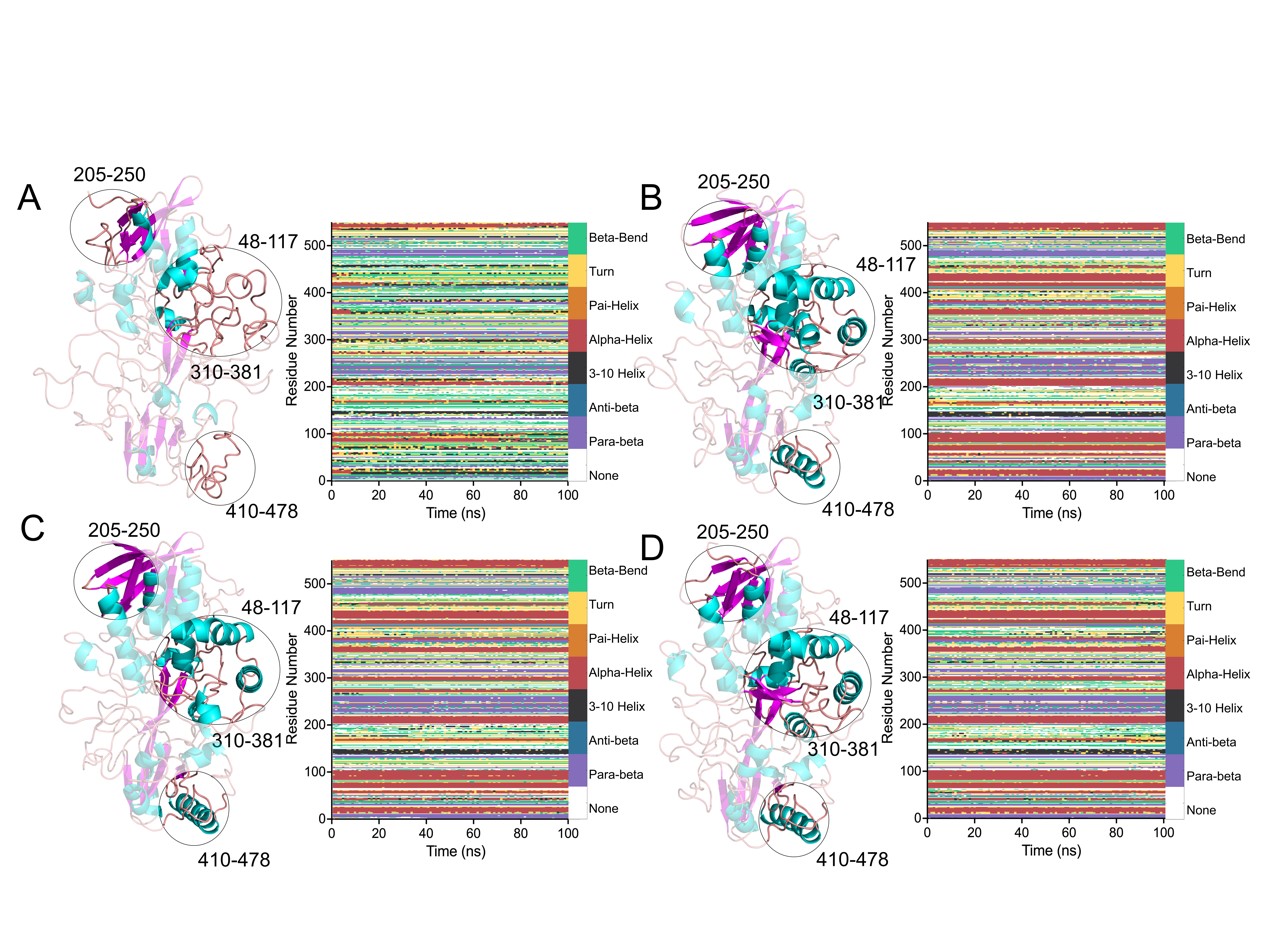
图4. WT及其突变体的模拟终状态3D结构及二级结构DSSP时序分析
(A) WT、(B) T311A、(C) M1和 (D) M3
突变体的PA高效转化
M1和M3在工业生产条件下表现良好,在高CA浓度(60 g·L-1)和超低酶浓度(6 g·L-1)下12 h内实现> 95%的PA产率,而WT仅有55%的转化率。本研究为KsdD通过理性分析而设计出更高效稳定的工程酶提供了新的思路,并用于高效率、低能耗、可持续的具有重要药用价值的Δ1-3-甾体药物的工业生产。
该研究工作得到了武汉大学生命科学学院科研资金与平台、湖北共同甾体药物研究院资金等的支持。同时感谢生命科学学院仪器共享平台费良丹老师的指导。
原文链接:https://doi.org/10.1016/j.ijbiomac.2024.137855
郑忠亮副教授实验室长期从事合成生物学、酶转化、结构生物学、生物信息学、蛋白工程改造和天然药物生物合成等方面研究,已取得多项天然药物生物合成技术成果。