(通讯员 杨雪)2024年8月20日,武汉大学生命科学学院陈学峰教授课题组在美国科学院院刊PNAS (Proceedings of the National Academy of Sciences of the United States of America)在线发表了题为“Rtt105 stimulates Rad51-ssDNA assembly and orchestrates Rad51 and RPA actions to promote homologous recombination repair” 的研究论文。该研究以酿酒酵母为模型,鉴定了Ty1转座子调节蛋白Rtt105为一个新的重组酶调节因子,发现Rtt105直接促进重组酶Rad51与单链DNA(ssDNA)的动态组装,并协调修复蛋白RPA与Rad51在ssDNA上的动态结合行为,从而在同源重组修复过程中发挥独特的调控作用。

同源重组对于保护停滞或塌陷的复制叉、修复染色体断裂以及减数分裂过程中的遗传信息交换都至关重要,是驱动进化的重要力量。同源重组修复相关基因突变通常会导致基因组不稳定,患乳腺癌、卵巢癌和前列腺癌等疾病的风险大大增加。同源重组修复的关键基因发生突变会导致小鼠胚胎致死。在同源重组修复过程中,复制蛋白A(RPA)能够迅速识别末端切除产生的 3′端ssDNA并与之结合。随后,重组酶Rad51需要及时替换RPA与ssDNA结合形成Rad51核蛋白纤丝,从而进行同源模板搜索、链入侵及后续修复过程。然而,人们对于细胞如何调控重组过程中Rad51-ssDNA的动态组装以及如何协调RPA和Rad51的功能的理解仍然十分有限。
课题组前期研究发现酿酒酵母Ty1转座子调控蛋白Rtt105通过调节RPA在ssDNA上的动态组装进而促进高保真的DNA复制与修复(Wang et al., PNAS, 2021,doi: 10.1073/pnas.2106393118)。在本研究中,结合质谱及生化技术,作者发现酵母Rtt105在体外和体内与重组酶Rad51相互作用,并确定了Rtt105中Y203和P204为介导二者互作的关键氨基酸。特异性破坏二者互作(rtt105-YP2A)导致Rad51在DNA损伤部位募集减少、同源重组效率降低及对DNA损伤试剂敏感。进一步结合生化及单分子技术,作者发现Rtt105能够在体外直接促进Rad51-ssDNA动态组装、D-loop形成及链交换反应,并揭示Rtt105可能主要是通过抑制Rad51的ATP水解酶活性实现的。值得注意的是,作者发现Rtt105通过不同的基序与Rad51及RPA互作并调控它们与ssDNA的结合,并证明了Rtt105对二者的调控在促进Rad51核纤丝组装、链交换和重组修复方面都是必需的。破坏任何一种相互作用都会导致同源重组修复缺陷及细胞对DNA损伤试剂的敏感性。上述结果说明Rtt105在协调Rad51和RPA在重组中的功能方面发挥独特的作用。同时,该研究发现了蛋白Rad51中存在一段进化保守的调控其ATP水解酶活性的氨基酸基序。该项研究为进一步深入理解同源重组的调控机制提供了新观点。
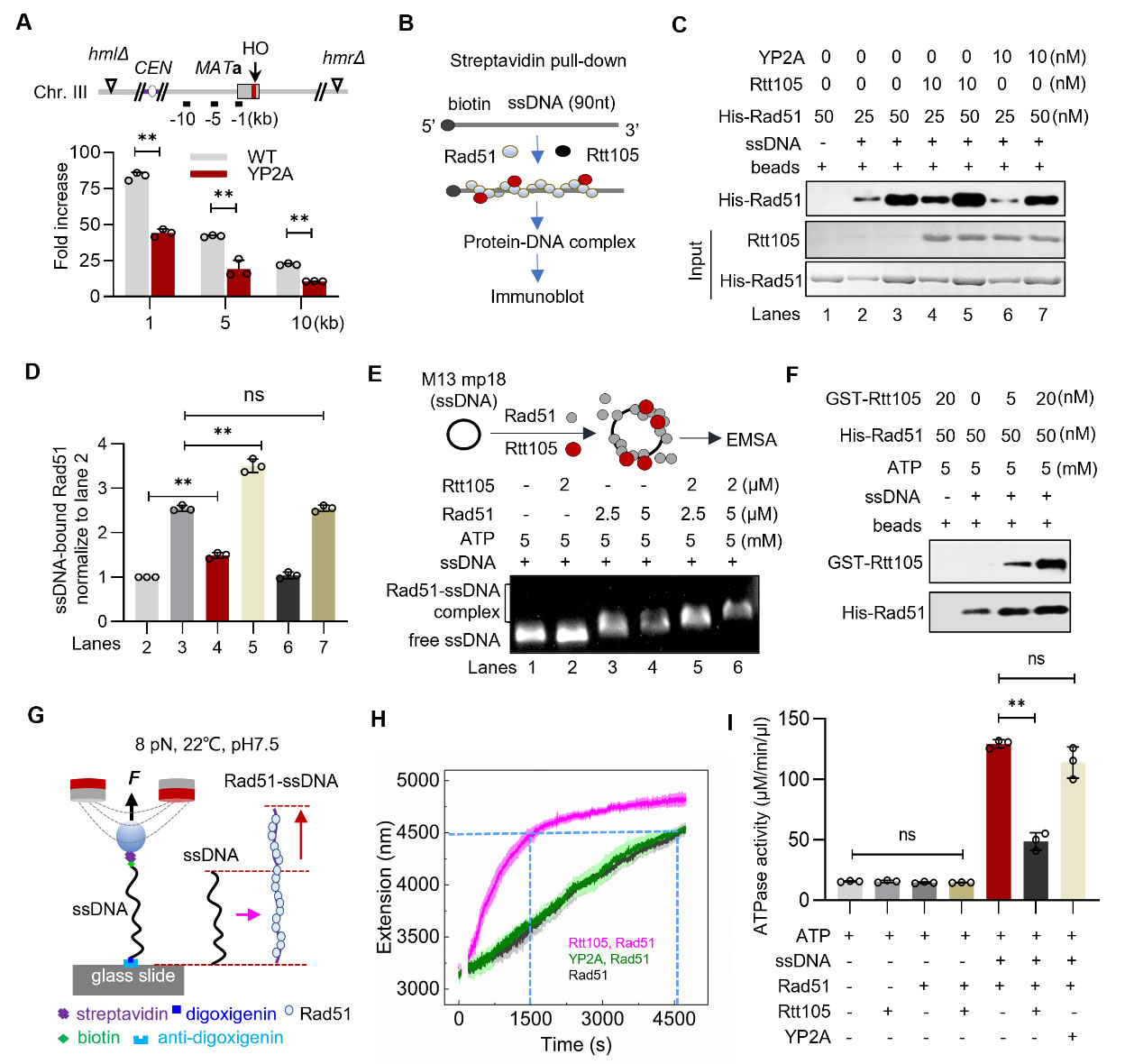
Rtt105通过抑制Rad51的ATPase酶活性来促进Rad51-ssDNA的组装
武汉大学生命科学学院博士后王雪杰为论文第一作者,陈学峰教授为该论文的通讯作者,武汉大学为第一完成单位。在项目实施过程中,武汉大学生命科学学院张兴华教授、赵晓聪博士及浙江大学周春教授提供了大力支持与帮助。该项目得到了国家重点研发计划项目、国家自然科学基金、中国博士后科学基金、湖北省自然科学基金、武汉大学泰康生命医学中心及免疫与代谢前沿科学中心等项目和机构的经费支持。
论文链接:Rtt105 stimulates Rad51-ssDNA assembly and orchestrates Rad51 and RPA actions to promote homologous recombination repair (pnas.org)。