2024年8月9日,武汉大学生命科学学院周宇教授团队在国际权威期刊Molecular Cell在线发表了题为“Nuclear retention coupled with sequential polyadenylation dictates post-transcriptional m6A modification in the nucleus”(核滞留与渐进式加尾决定了细胞核中的转录后m6A修饰)的研究论文。该研究发现,远端polyA位点加工产生的长3′UTR转录本会被m6A修饰复合物在转录后进一步修饰,而通过sequential polyadenylation,m6A修饰水平更高的短3′UTR转录本被释放到细胞质。

哺乳动物中超过70%的蛋白编码基因具有多个polyA位点,不同polyA位点的选择被称为可变多聚腺苷酸化(Alternative polyadenylation,APA)。之前的研究认为,APA发生过程中近端polyA位点和远端polyA位点的加工都是共转录发生的,二者相互独立。周宇教授团队前期发现了“渐进式可变多聚腺苷酸化(Sequential polyadenylation,SPA)”的加工新模式:远端强polyA位点优先被选择产生长3′UTR转录本,继而在近端弱polyA位点进一步切割,产生短3′UTR转录本释放到细胞质(NSMB, 2022)。但这种新型的渐进式可变加尾的生物学意义尚不明确。
m6A作为mRNA内部最丰富的RNA修饰,在发育、免疫等过程发挥了重要的作用。在分子水平上,m6A在细胞核内调控了RNA的剪接和APA。但目前关于m6A修饰和RNA加工相互调控关系的数据和模型存在一定的冲突,例如m6A修饰水平和RNA的3′UTR长度呈正相关,但同一个基因的短3′UTR转录本,而不是长3′UTR转录本,选择性地被m6A所修饰。
在该研究中,作者观察到长3′UTR转录本会滞留于nuclear speckles(核斑)。考虑到m6A修饰复合物的组分也在nuclear speckles富集,作者提出假设:滞留于nuclear speckles的长3′UTR转录本会进一步在转录后发生m6A修饰,从而造成m6A修饰水平和RNA的3′UTR长度呈正相关;而通过sequential polyadenylation的第二步切割,则会造成同一个基因的短3′UTR转录本而不是长3′UTR转录本被m6A所修饰。由于以前的报道认为m6A修饰主要是共转录发生的,作者首先鉴定了m6A修饰能否在转录后进一步发生?为此,作者在前人开发的m6A-LAIC-seq和GLORI的基础上,结合新生RNA标记技术,开发了4sU-m6A-LAIC-seq和4sU-GLORI方法。通过比较新生(nascent)RNA,包括无polyA尾和带有polyA尾的新生RNA,以及稳定状态(steady-state)下的RNA的m6A水平,作者发现转录后m6A修饰是一个普遍的现象,而且相比较于未发生转录后m6A修饰的RNA,发生转录后m6A修饰的RNA在稳定状态下m6A修饰水平更高。
进一步,作者为了证明RNA的核滞留能够增强m6A修饰水平,一方面构建了HBB-gDNA(含有intron)和HBB-cDNA(不含intron)报告质粒:两个reporter最终产生的RNA序列完全一样,但只有HBB-gDNA来源的RNA能够有效转运出核,而HBB-cDNA来源的RNA则会滞留于细胞核内;另一方面,利用AID2系统对mRNA转运出核因子NXF1进行快速降解以诱导mRNA核滞留。随后,分别对Reporter来源的 RNA和内源基因来源的RNA进行GLORI定量。单个reporter和转录组规模的实验结果都证明了RNA的核滞留确实能够提高m6A的修饰水平,这也暗示着长3′UTR也有可能通过RNA核滞留增强m6A修饰水平。鉴于渐进式可变多聚腺苷酸化的发生是由于近端polyA位点弱于远端polyA位点,作者进一步通过改变近端polyA位点的强度以破坏或保留渐进式可变多聚腺苷酸化的发生,得到的实验结果进一步表明渐进式可变多聚腺苷酸化可以促进m6A修饰。
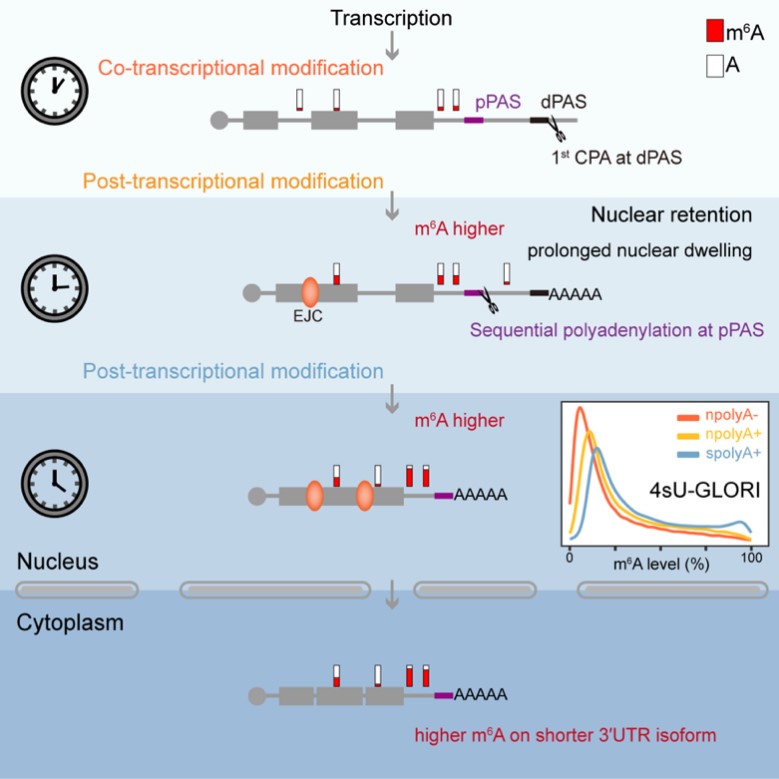
综上,该研究提出了渐进式多聚腺苷酸化与核滞留共同决定转录后m6A修饰的新机制:在渐进式多聚腺苷酸化过程中,远端polyA位点加工产生的长3′UTR转录本滞留于细胞核内,额外的核滞留时间使得m6A修饰复合物可以在转录后对mRNA继续进行修饰,从而进一步提高其m6A修饰水平。该研究为理解m6A等修饰与APA调控提供了新思路,为解决领域冲突提供了新视角。
武汉大学生命科学学院周宇教授为该论文的通讯作者,周宇教授课题组的博士后唐鹏(现为中国科学院广州生物医药与健康研究院副研究员)、博士生杨家益、已毕业硕士生陈宗贵为共同第一作者,武汉大学为第一单位,课题组的博士生杜辰、杨阳、黄丽、李广楠、刘飞燕、山挺等参与了该研究,中国科学院广州生物医药与健康研究院鲍习琛研究员课题组对该研究提供了大力支持与帮助。同时,该研究也得到了付向东教授、伊成器教授、刘默芳研究员、程红研究员、李国红教授等的支持和帮助,受到国家自然科学基金委优青、科技部和中央高校基础研究基金等项目的资助。
原文链接:https://doi.org/10.1016/j.molcel.2024.07.017