近日, 国际权威期刊Nucleic Acids Research (IF=11.56) 在线发表了我院遗传学系、细胞稳态湖北省重点实验室陈学峰教授课题组的研究论文,题目为“Bre1-dependent H2B ubiquitination promotes homologous recombination by stimulating histone eviction at DNA breaks”。本研究以酿酒酵母为材料,阐明了E3泛素连接酶Bre1所介导的H2B泛素化在染色体断裂修复中的作用及机制。
DNA双链断裂(DNA double-strand breaks,DSBs)是不同类型DNA损伤中危害最为严重的类型之一。若不能及时修复或发生错误修复,则可能导致基因组不稳定,甚至引起细胞发生癌变或死亡。在真核生物中,细胞通过两种主要方式修复DSBs,即:同源重组修复(Homologous recombination)和非同源末端连接(Non-homologous end joining)。DNA损伤会引发染色质上损伤部位产生多种类型的表观遗传修饰,而损伤修复又受到染色质结构与状态的影响;这些修饰如何调控DNA修复过程仍不完全清楚。
该研究发现了Bre1介导的H2B泛素化发挥两个重要的功能。一方面,通过刺激下游H3K79的甲基化从而促进Rad9蛋白的招募。因为Rad9对DNA断裂末端切除有负调控作用,所以Bre1具有防止末端过度切除的作用。另一方面,发现了Bre1介导的H2B泛素化能够促进组蛋白从断裂末端产生的单链DNA上解离,并且发现该过程并不依赖于染色质重塑复合物。组蛋白从单链DNA上的解离有利于后续DNA重组蛋白Rad51结合到单链DNA上,从而促进了同源重组修复。该研究首次为组蛋白八聚体能够与单链DNA结合提供了体内实验证据,也揭示了组蛋白的动力学变化会影响DNA重组蛋白的装载,进而影响修复过程。
我院博士研究生郑斯豪承担了主要研究工作,是论文第一作者,中国科学院生物物理研究所李国红研究员课题组参与了该项研究,陈学峰教授为论文通讯作者。该项研究受到国家重大基础研究计划(973)和国家自然科学基金委面上项目的资助。
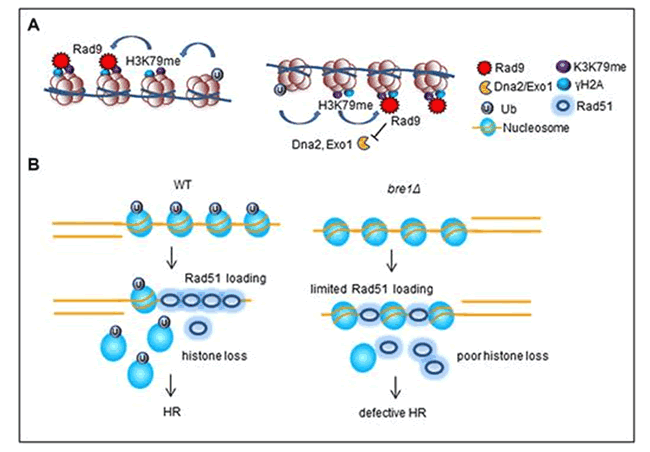
图注:Bre1介导的H2B泛素化调控同源重组的分子机制