2020年10月21日,国际学术期刊《Cell Death Differentiation》在线发表了武汉大学生命科学学院周荣家和程汉华教授团队的最新研究成果。论文题目为“SPATA33 is an autophagy mediator for cargo selectivity in germline mitophagy”(SPATA33是生殖系线粒体自噬中货物选择性的自噬中介因子)。该项研究揭示了生殖系线粒体选择性自噬的分子机制。该机制的认识对于理解自噬在细胞稳态的调节和功能维持中的作用具有重要的科学意义。
细胞自噬参与了发育、代谢、癌症发生、神经退行性疾病和病毒清除等广泛的生理和病理过程。受损的细胞器和大分子通过自噬途径进行分解代谢和再循环,对于细胞结构重塑和维持细胞稳态发挥着重要作用。近年来,细胞器的选择性自噬机制的探索已经成为细胞生物学研究的热点领域。然而,自噬机器如何识别并选择性清除受损的细胞器仍然了解甚少。
SPATA33是本实验室前期发现并命名的新基因,该基因只存在于人类和小鼠等哺乳动物中,在生殖系细胞中特异表达。该研究通过对SPATA33基因的系统探索,发现SPATA33是生殖系细胞中线粒体与自噬前体的中介因子,在自噬诱导条件下,介导受损的线粒体进入自噬前体,并通过自噬途径进入分解代谢,进行降解。研究显示,SPATA33一方面与线粒体外膜蛋白VDAC2结合,识别线粒体,另一方面与自噬机器关键蛋白ATG16L1互作,并且促进线粒体的自噬。因此,鉴定了SPATA33作为线粒体自噬的中介因子,行使自噬货物的选择性作用。
博士生张英和徐煦为共同第一作者,周荣家教授和程汉华教授为该论文通讯作者。该项工作得到了国家科技部重点研发计划和国家自然科学基金的资助。
该项工作是该团队2020年在细胞自噬的分子机制和功能研究方面的系列成果之一,Cell Death Differentiation (2020年2月)、Autophagy (2020年4月)以及Molecular Biology Evolution (2020年7月) 先后报道了该实验室在自噬方面的研究进展。
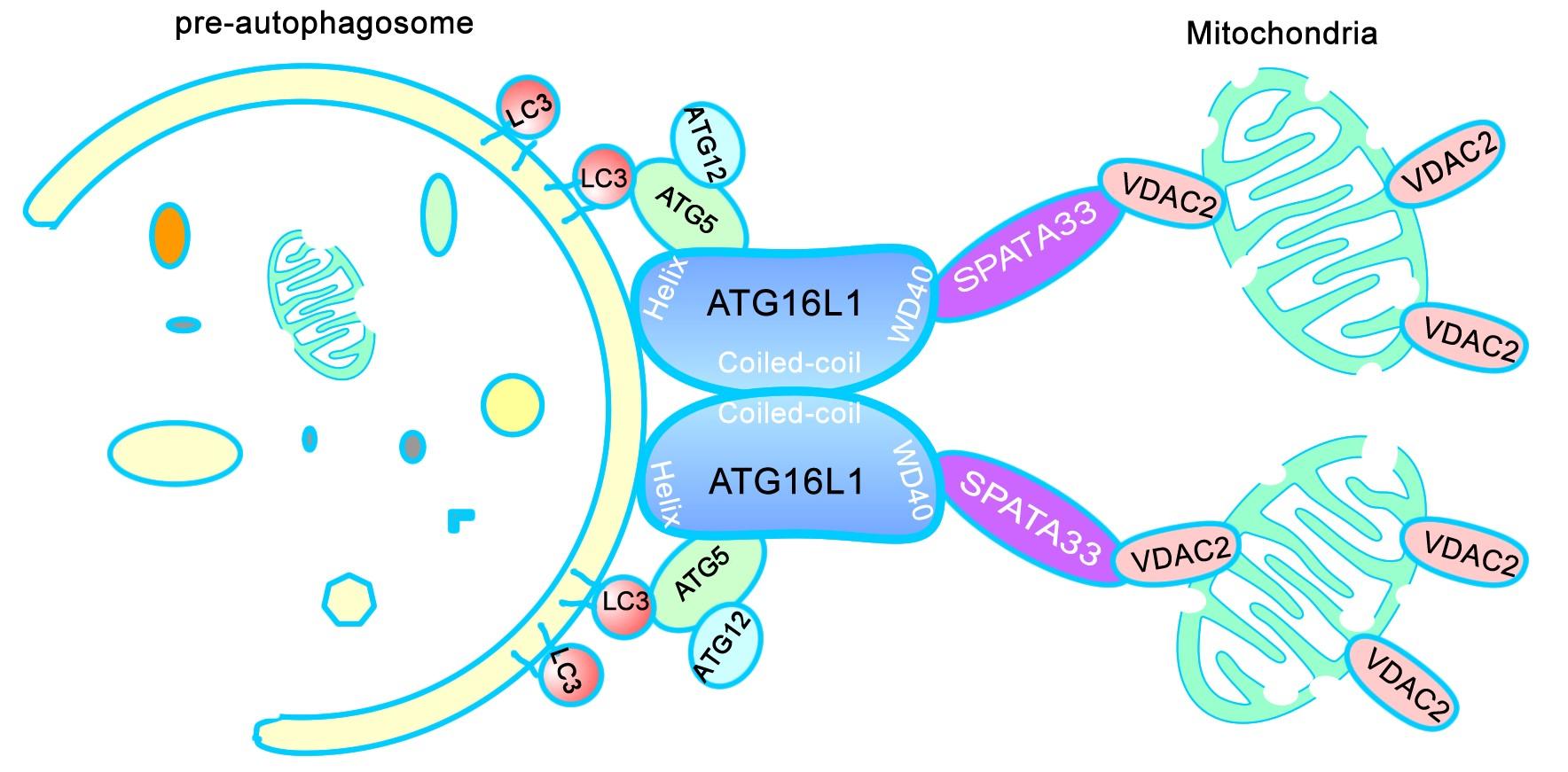
图示:中介因子SPATA33介导线粒体自噬的分子机制
论文链接:https://www.nature.com/articles/s41418-020-00638-2