2020年11月5日,国际综合性期刊《自然•通讯》在线发表了武汉大学生命科学学院徐永镇、樊玉杰团队在脊肌萎缩症相关的次要剪接调控和功能研究中的新成果。论文题目为“Defective minor spliceosomes induce SMA-associated phenotypes through sensitive intron-containing neural genes in Drosophila”。
脊肌萎缩症(Spinal Muscular Atrophy, SMA)是一类主要由SMN基因缺陷引起的运动神经元变性和肌肉萎缩遗传性疾病,在我国新生儿中的患病率为1:6,000-1:10,000。与SMA病人类似,SMN基因缺陷型小鼠和果蝇也都呈现出运动神经元和肌肉发育缺陷。尽管主要(U2-type)和次要(U12-type)剪接体的组装都需要SMN蛋白,但次要剪接对SMN的缺失更为敏感。然而已有研究都集中在SMN基因,脊肌萎缩症的下游致病基因和次要剪接调控机制一直未有充分探索。
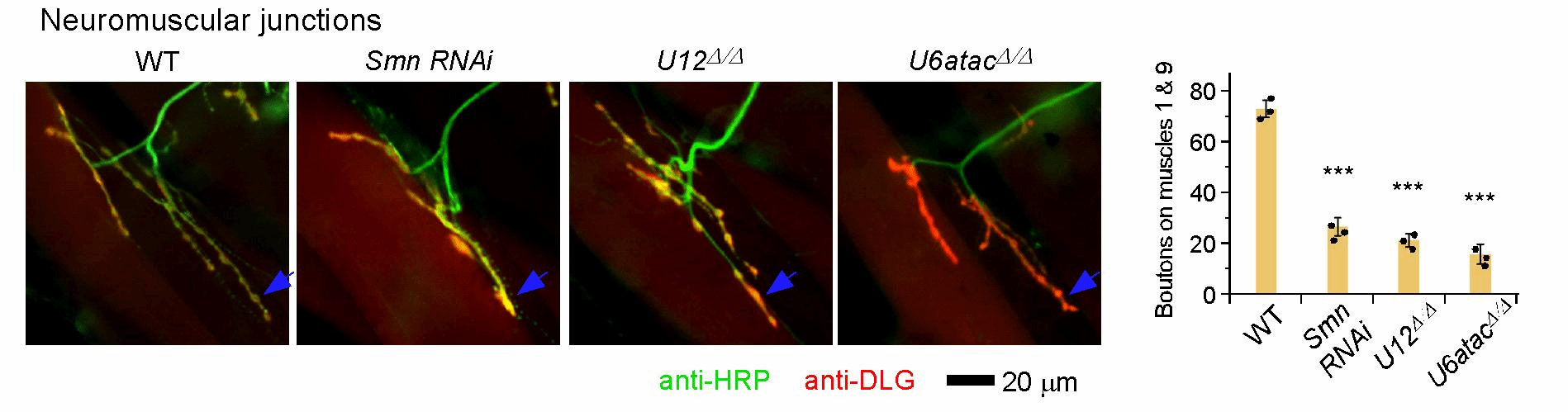
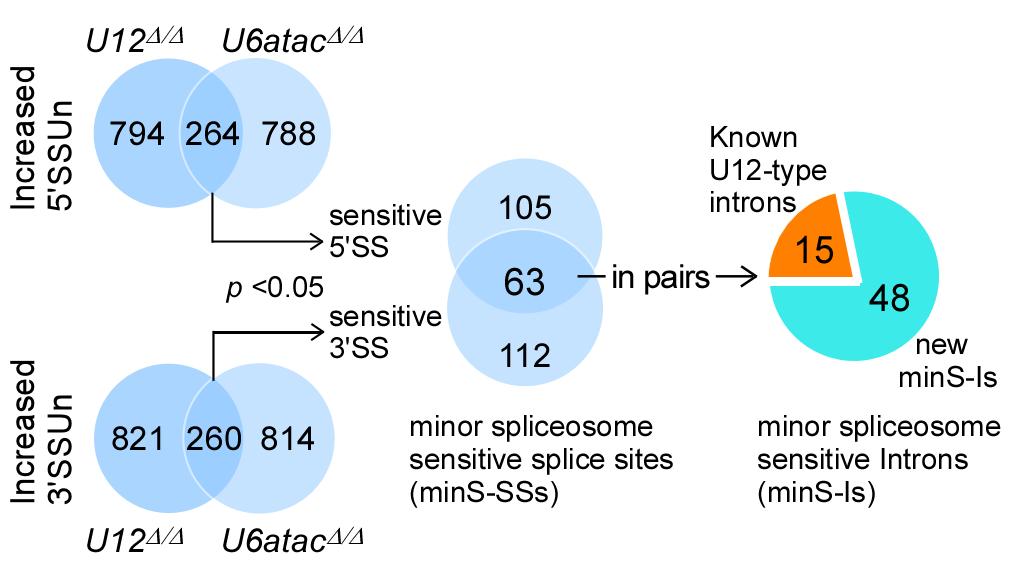
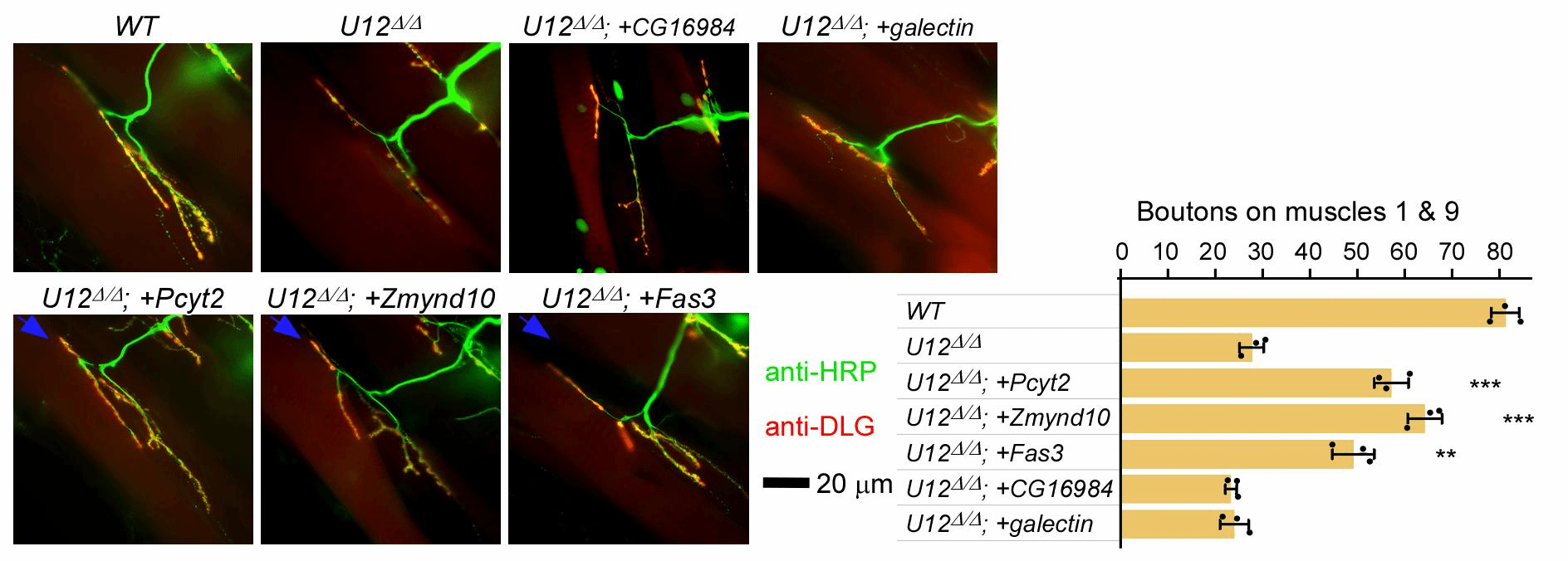
为更深入地研究、理解脊肌萎缩症,研究团队首先利用基因组编辑技术精确地在果蝇体内分别敲除了次要剪接体的两个RNA组分:U12和U6atac snRNA。这两种突变体均表现出典型的运动神经元发育和运动能力缺陷,直接证明次要剪接缺陷即可导致SMA表型。随后开展了突变体和野生型的转录组测序,借助自主设计开发的生物信息学方法,发现除了以往预测的19个U12型内含子,果蝇基因组中至少还存在250多个次要剪接敏感的剪接位点和48个敏感内含子,涉及33个神经功能相关基因。此后通过大量遗传学筛选,发现回补其中3个基因—Zmynd10, Pcyt2, Fas3—可以有效地拯救SMN缺陷导致的SMA表型。另外,研究团队还发现众多的敏感性剪接位点可以被次要剪接体和主要剪接体竞争性识别,揭示出一种新的内含子选择性识别和剪接机制。因此,该项研究显著地拓宽了次要剪接体识别和催化的内含子范围,鉴定出3个果蝇SMA发病下游基因,为研究人类SMA疾病提供了新的靶点与更高效准确的分析方法。
近年来,研究团队取得的成果包括人类血液肿瘤疾病中SF3B1高频突变导致RNA紊乱的分子机制(Genes Dev, 2016)、保守内含子元件促进反式剪接发生的新机制(Genes Dev, 2015)、转录与剪接的双向偶联机制(NAR, 2020)等。未来团队将围绕RNA剪接参与的发育与疾病等生理病理进程,继续开展深入研究。
博士生李梁为论文的第一作者,博士生丁展、庞亭林协助开发了新的生物计算方法,徐永镇教授与樊玉杰副研究员为共同通讯作者。该研究获得了国家自然科学基金委杰出青年科学基金、重大研究计划和面上项目资助。
论文的网站链接:https://www.nature.com/articles/s41467-020-19451-z;实验室网站链接:https://xu-lab-whu.github.io/。