2021年5月30日,国际期刊《Advanced Science》(IF 15.8)在线发表我院遗传学系、细胞稳态湖北省重点实验室陈学峰教授课题组最新研究成果,论文题目为“Yeast Bromodomain Factor 1 and Its Human Homolog TAF1 Play Conserved Roles in Promoting Homologous Recombination” (doi: 10.1002/advs.202100753)。该研究揭示了酵母溴结构域家族蛋白Bdf1及其人类同源蛋白TAF1在促进DNA同源重组修复中的保守功能与机制。

在真核生物中,DNA缠绕组蛋白八聚体形成核小体,并以核小体为基本单位高度压缩形成染色质。DNA的转录、复制和修复等过程均受到组蛋白翻译后修饰的精密调控。由乙酰转移酶NuA4/TIP60介导的组蛋白H4 氮端的乙酰化修饰在上述过程中发挥着关键作用,但组蛋白乙酰化信号如何传递并调控DNA损伤修复过程尚不明晰。在真核生物中存在一类专门识别乙酰化修饰的含有溴结构域(Bromodomain)的蛋白,目前对该类蛋白在DNA修复和维持基因组稳定性中的功能了解的还十分有限。
该课题组以模式生物酿酒酵母为模型,通过筛选组蛋白乙酰化相关蛋白,发现溴结构域蛋白Bdf1与DNA损伤修复密切相关。敲除BDF1基因引起DNA末端加工、检查点激活以及修复蛋白招募出现缺陷,从而导致细胞同源重组修复效率下降以及对DNA损伤药物抗性降低。进一步,作者揭示了Bdf1蛋白的溴结构域在上述过程中发挥关键作用,并证明了Bdf1通过其溴结构域结合染色质上乙酰化的组蛋白H4。此外,作者还通过质谱分析和生化实验发现Bdf1与DNA修复蛋白RPA相互作用,并定位了介导互作的区域;阻断Bdf1结合染色质或者破坏其与RPA的相互作用都导致同源重组修复效率下降,并且二者表现出上位性效应。然而,过量表达RPA能够显著回复上述突变体的重组缺陷。通过与乔治华盛顿大学裴华东课题组合作,作者将研究延伸到人类细胞,发现Bdf1在人类细胞中的同源蛋白TAF1也具有促进同源重组修复的功能,并证明了该机制在人类细胞中是保守的。由此,作者得出结论: DNA发生断裂后,损伤位点附近的染色质会发生NuA4/TIP60介导的H4乙酰化,Bdf1通过其溴结构域结合乙酰化的染色质;同时,Bdf1通过与RPA的直接互作促进或稳定RPA在染色体上的结合,从而促进同源重组修复,且这一功能与机制高度保守。该项研究对于全面揭示组蛋白乙酰化和溴结构域家族蛋白在维护基因组稳定性中的功能与机制具有重要意义。
我院博士生彭昊阳、张思敏以及乔治华盛顿大学彭奕涵博士为共同第一作者,陈学峰教授和乔治华盛顿大学裴华东教授为共同通讯作者,我校为第一作者单位。北京大学李晴教授和我院张兴华教授实验室参与了研究。该项成果得到了国家自然科学基金和武汉大学研究生院《遗传学》课程项目的资助。
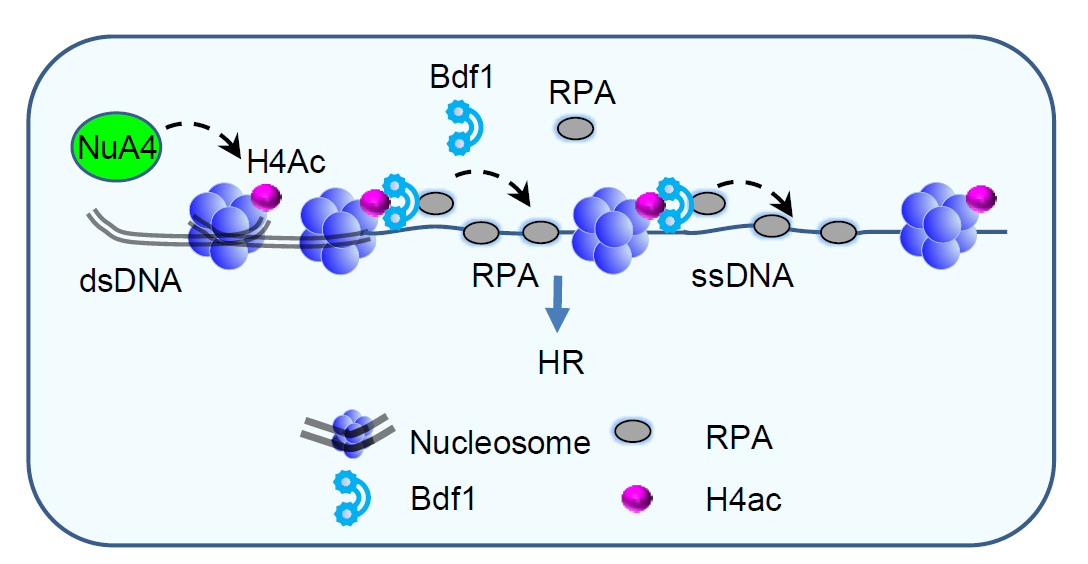
图1 Bdf1偶联H4乙酰化修饰和DNA重组修复过程