2022年6月10日,《eLife》在线发表武汉大学生命科学学院、病毒学国家重点实验室姚镜教授课题组的最新研究进展,论文题为“Tyrosine phosphorylation tunes chemical and thermal sensitivity of TRPV2 ion channel (酪氨酸磷酸化动态修饰精细调控TRPV2通道对化学激动剂和温度的敏感性)”。
TRPV2通道是一种对二价阳离子具有较高选择通透性的阳离子通道,在神经组织和非神经组织广泛分布,在不同组织中发挥多样化的功能。作为一种多觉感受器(Polymodal receptor),TRPV2通道响应伤害性温度(>52oC)、机械力、渗透压和化学物质等多种类型刺激,在疼痛、神经轴突生长与发育、机械感受、心脏结构与功能维持、胰岛素分泌、促炎反应、肿瘤发生与转移及免疫应答等多种生理病理过程中发挥重要作用。为维持自身稳态,细胞必须能够对其内部和外部环境的快速变化作出反应,而应对这些变化主要靠胞内不同蛋白质的功能。发现和解析通道蛋白新的调控策略,不仅有助于丰富离子通道活性的调控手段,同时还为相关疾病的诊疗提供新的分子靶标与理论基础。
蛋白质翻译后修饰能够发生在蛋白质“生命周期”的任何时期,通过各种信号通路激活不同的酶,相应的酶诱导蛋白质一个或多个氨基酸侧链与功能性化学基团共价结合,在调节蛋白质的活性、稳定性、定位、相互作用或折叠中起关键作用。在这项工作中,研究人员发现提高细胞内的Mg2+含量能够有效增强表达在巨噬细胞和背根神经元中的TRPV2通道对化学激动剂和温度的敏感性。进而综合利用蛋白质谱技术、分子生物学定点突变技术、蛋白体外磷酸化重组实验、快速恒定升温系统和膜片钳电生理实验等技术,研究人员发现细胞内Mg2+浓度的增加能够提高酪氨酸磷酸激酶JAK1的活性,进而磷酸化修饰TRPV2通道蛋白上的三个关键酪氨酸残基(Tyr 335,Tyr 471和Tyr 525)。TRPV2通道蛋白磷酸化水平的提高不仅增强了通道对化学激动剂的敏感性,并且极大地降低通道的温度激活阈值。进一步,在巨噬细胞中开展的吞噬实验还表明抑制或敲低JAK1下调TRPV2的磷酸化水平能有效降低巨噬细胞的吞噬能力。
蛋白的磷酸化与去磷酸化始终处于动态平衡过程中,为探明参与调控TRPV2去磷酸化过程的酪氨酸磷酸酶类型,该研究通过使用磷酸酶抑制剂和shRNA技术选择性敲低不同酪氨酸磷酸酶的蛋白表达进行筛选,最后发现蛋白酪氨酸磷酸酶非受体1型(Protein tyrosine phospase non-receptor type 1, PTPN1)磷酸酶介导了TRPV2通道蛋白的去磷酸化过程。有趣地是,抑制PTPN1磷酸酶活性亦能够提高TRPV2蛋白的酪氨酸磷酸化修饰水平,进而增强TRPV2通道对化学刺激的敏感性,并将其温度激活阈值由53 oC显著降低至~40 oC。
姚镜课题组围绕在生理病理中具有丰富功能的TRPV2通道的内源调控机制进行了深入研究,前期发现并揭示了脂筏组成蛋白Flotillin-1通过与TRPV2通道的N末端和跨膜蛋白TM1-4相互作用能够增强TRPV2通道蛋白在细胞膜上的稳定性而提高通道在细胞膜上的表达量,进而提高通道活性(Front. Cell Dev. Biol., 2021)。本研究则发现JAK1和PTPN1介导的酪氨酸磷酸化修饰能够动态调控TRPV2通道活性,增强通道对化学和温度刺激的敏感性(图1),并进而参与调控巨噬细胞的吞噬能力。该研究结果进一步丰富了TRPV2通道功能的内源调控策略,促进了对TRPV2通道感温机理的认识。
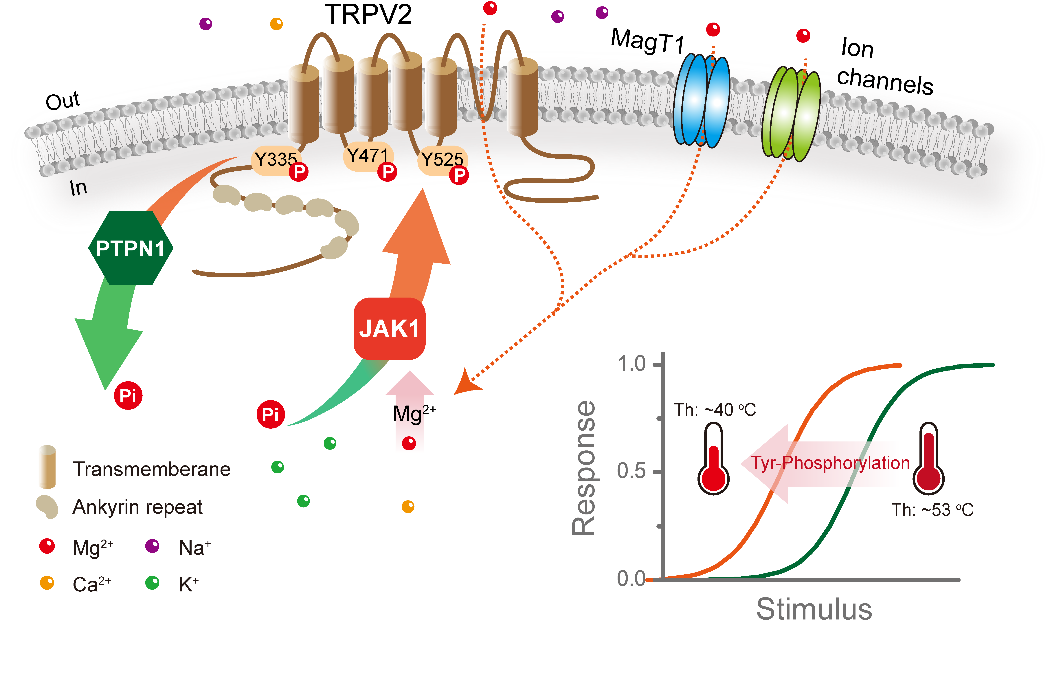
图1. 酪氨酸磷酸化动态修饰精细调控TRPV2通道活性的示意图
武汉大学生命科学学院的博士研究生莫晓怡和庞培源为本文的共同第一作者,王宇霖、江德祥、张梦予、李阳、王培宇、耿奇志等同学也参与了研究,姚镜教授为通讯作者。此外,武汉大学的谢畅高级实验师,杜海宁教授和钟波教授,法国国家健康与医学研究院的李栋栋研究员也参与了该项研究。该研究工作得到了国家自然科学基金、湖北省自然科学基金和中央高校基本科研业务费专项资金等的项目资助。
论文链接:https://elifesciences.org/articles/78301