2024年5月8日,武汉大学生命科学学院刘勇教授课题组在Nature Cell Biology杂志上在线发表了题为“Mammalian IRE1α dynamically and functionally coalesces with stress granules” 的研究论文,发现IRE1α能够在不同应激条件下与应激颗粒(Stress granule, SG)通过相分离形成共聚集簇,提示IRE1α与应激颗粒的协同共聚能够富集IRE1α-XBP1通路中的关键组分,为IRE1α蛋白机器提供了一个更为高效的运行平台,从而赋予细胞更强的应激处理能力。
真核细胞在遭受外界不利条件的胁迫时,细胞稳态往往被扰乱,导致细胞功能的正常运行乃至存活都面临挑战。细胞中的内质网作为蛋白质合成、折叠、加工和运输的重要场所,外部刺激导致的蛋白质稳态失衡会引起未折叠或错误折叠蛋白质在内质网中的积累,引发内质网应激(Endoplasmic reticulum stress,ER stress)。细胞通过激活未折叠蛋白响应(Unfolded protein response,UPR)通路以应对未折叠蛋白质的超量积累,缓解内质网的蛋白质折叠压力,进而协助维持细胞内的蛋白质稳态。肌醇需要酶1(Inositol-requiring enzyme 1,IRE1)是位于内质网上的跨膜蛋白,通过激活其胞内段蛋白激酶和核糖核酸内切酶的双重活性,起始并控制着未折叠蛋白响应中最为保守的一条信号通路。在内质网应激条件下,哺乳动物细胞中IRE1α通过剪切编码X盒结合蛋白1(X-box binding protein 1,XBP1)mRNA底物产生剪接形式的XBP1s (spliced XBP1)mRNA并翻译出具有转录活性的XBP1s转录因子,以此调控下游应激响应蛋白的表达。以往大量研究表明,激活的IRE1α能够形成显微可见的聚集簇,而人们对于IRE1α聚集簇的形成这一细胞生物学现象,在其结构特性、动态特征乃至具体功能方面迄今仍然处于十分模糊的认知阶段。
为了深入解析在哺乳动物细胞中IRE1α聚集簇的结构与功能特性,研究人员利用免疫荧光检测、活细胞成像、光遗传学、免疫共沉淀及细胞组分分离等分子与细胞生物学技术手段,发现在不同应激条件刺激下,IRE1α聚集体的形成是在内质网膜附近发生的相分离事件,位于内质网的IRE1α聚集簇可以动态地与应激颗粒结合,并与应激颗粒的组装同步偶联,形成IRE1α-SG共聚集簇;IRE1α胞质段连接内质网跨膜结构域和激酶结构域的连接区(Linker)中含有内在无序区域(Intrinsically disordered region, IDR),是推助与应激颗粒共聚集的关键结构域。此外,破坏细胞应激颗粒的组装则会阻止IRE1α聚集簇的形成,并影响其对XBP1 mRNA的剪切加工效率;特别是在内质网应激状况下,IRE1α-SG凝聚体能够富集IRE1α-XBP1信号途径的关键生化成分,包括RtcB连接酶和XBP1 mRNA底物。这些研究结果展示了IRE1α-SG凝聚体在时空上的动态特征,表明通过相分离形成的IRE1α-SG凝聚体能够产生更为高效的IRE1α内切酶加工机器,从而增强细胞应对内质网应激的能力,维护细胞的功能稳态。
综上,此项研究工作揭示了IRE1α在细胞抗逆应激响应中前所未知的细胞生物学机制,为全面了解IRE1α这一古老应激感应分子在不同生理与病理应激过程中的功能和机制提供了新的视角。武汉大学生命科学学院博士研究生刘松子、张潇戈和姚鑫为本研究的共同第一作者,刘勇教授为通讯作者。该项研究得到国家重点研发计划和国家自然科学基金委重点项目等基金的资助支持。
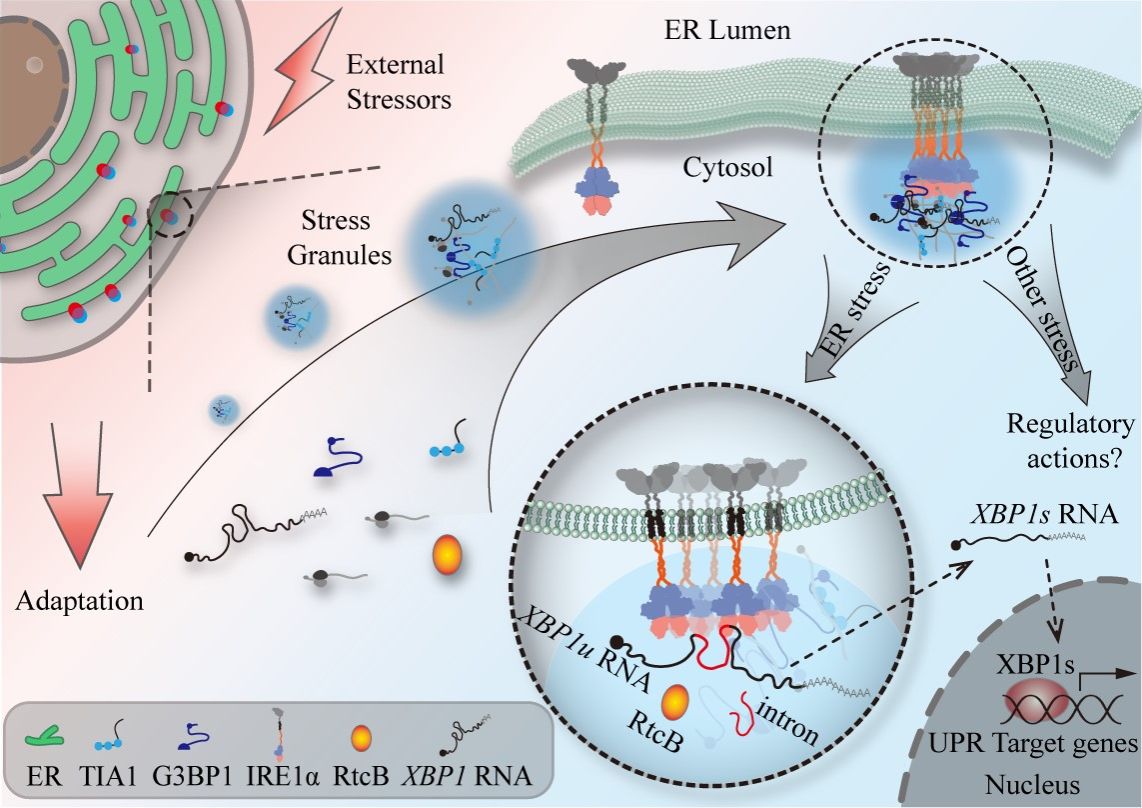
图1. 哺乳动物细胞中IRE1α-SG共聚集簇的功能机制示意图
原文衔接:https://www.nature.com/articles/s41556-024-01418-7